(Huntington- Credito: DOI: 10.1038/s41467-021-26684-z).
La malattia di Huntington è una malattia cerebrale progressivamente debilitante che causa movimenti incontrollati, problemi psicologici e perdita di cognizione. L’Huntington è causata da una mutazione nel gene che codifica per l’huntingtina, una proteina che normalmente svolge un ruolo importante nel mantenere le cellule cerebrali sane e attive. Ma la mutazione dà all’huntingtina una coda anormalmente lunga di aminoacidi glutammina, che fa sì che l’huntingtina si aggrega all’interno dei neuroni e alla fine li uccida.
Questi aggregati o corpi di inclusione dell’huntingtina sono stati oggetto di molti sforzi di ricerca nel tentativo di trovare un modo per comprendere e trattare l’Huntington. Ciò che è mancato, tuttavia, è un’analisi approfondita dell’ultrastruttura delle inclusioni, un termine che descrive il livello di struttura che si trova oltre la capacità di osservazione di un microscopio convenzionale.
Guardando in profondità
Utilizzando microscopia e proteomica avanzate, gli scienziati guidati da Hilal Lashuel dell’EPFL, in collaborazione con la Biological Electron Microscopy Facility, hanno ora condotto con successo il primo studio che interroga sia l’ultrastruttura dei corpi inclusi dell’huntingtina, sia la loro composizione nelle cellule che modellano la formazione patologica della malattia di Huntington. Il lavoro è pubblicato su Nature Communications .
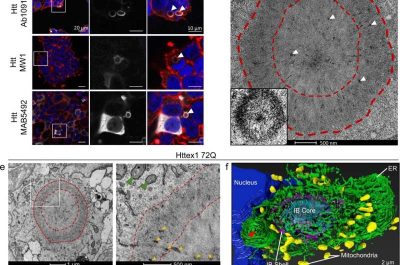
I ricercatori hanno utilizzato una tecnica avanzata nota come microscopia elettronica a luce correlativa (CLEM) in grado di identificare le inclusioni in diversi compartimenti cellulari (citoplasma o nucleo) e studiarne le caratteristiche strutturali e organizzative dei neuroni coltivati all’interno. La strategia CLEM combina essenzialmente un microscopio elettronico con un microscopio a fluorescenza. Il primo fornisce informazioni ad alta risoluzione fino alla nanoscala, mentre il microscopio a fluorescenza può (letteralmente) evidenziare le regioni di interesse.
I ricercatori hanno anche utilizzato la tomografia elettronica, che ha permesso loro di visualizzare i singoli aggregati all’interno di queste inclusioni. “Volevamo andare oltre la semplice pittura di un quadro dettagliato di come si formano queste inclusioni”, afferma Nathan Riguet, primo autore dello studio. “Questo è il motivo per cui abbiamo esteso i nostri studi per capire come si formano queste inclusioni, come influenzano il loro ambiente subcellulare, la funzione degli organelli nelle loro vicinanze e, in definitiva, la vitalità dei neuroni”.
Diversi meccanismi di aggregazione
Lo studio ha scoperto che l’aggregazione dell’huntingtina e la formazione di inclusioni nel citoplasma e nel nucleo dei neuroni avviene attraverso meccanismi diversi, portando a proprietà biochimiche e ultrastrutturali distinte. Ciò significa che questi due tipi di inclusioni possono anche essere tossici in modi diversi e che i trattamenti devono impiegare strategie diverse per affrontare la loro formazione, maturazione e tossicità.
Lo studio suggerisce anche che trovare modi per modificare la crescita delle inclusioni e le loro interazioni con altre proteine e organelli è una strategia valida, alternativa o complementare per rallentare la progressione dell’Huntington, soprattutto dopo l’insorgenza della malattia. Questo perché questo processo porta al sequestro di proteine funzionali e interrompe la funzione di importanti organelli nella cellula come i mitocondri. Gli autori affermano: “…Noi crediamo che mirare alla crescita e alla maturazione dell’inclusione rappresenti una strategia terapeutica praticabile”.
Vedi anche:Huntington: origini rilevate in embrioni umani
Tag fluorescenti
“I nostri risultati mettono anche in guardia contro l’uso di grandi tag di proteine fluorescenti per sviluppare modelli di malattia di Huntington e schermare i farmaci che modificano l’aggregazione di Huntingtina e la formazione delle inclusioni”, afferma Lashuel. “Ciò ha implicazioni significative per la malattia di Huntington e altre malattie neurodegenerative, in cui la fusione di proteine fluorescenti è comunemente usata per studiare i meccanismi di aggregazione proteica e nella scoperta di farmaci”.
“Il nostro lavoro apre nuove intuizioni sulla composizione e l’ultrastruttura delle inclusioni di huntingtina“, conclude. “Avanzano la nostra comprensione dei meccanismi di aggregazione dell’huntingtina, ma indicano anche nuove direzioni per gli interventi terapeutici, che intendiamo perseguire”.
Fonte:Nature