(Intestino-cervello-Immagine: i ricercatori del MIT hanno sviluppato un sistema “organi su chip” che replica le interazioni tra cervello, fegato e colon. Credito: Martin Trapecar, MIT).
In molti modi, il nostro cervello e il nostro tratto digerente sono profondamente connessi. Il nervosismo può causare dolore fisico allo stomaco, mentre i segnali di fame dall’intestino ci fanno sentire irritabili. Studi recenti hanno persino suggerito che i batteri che vivono nel nostro intestino possono influenzare alcune malattie neurologiche.
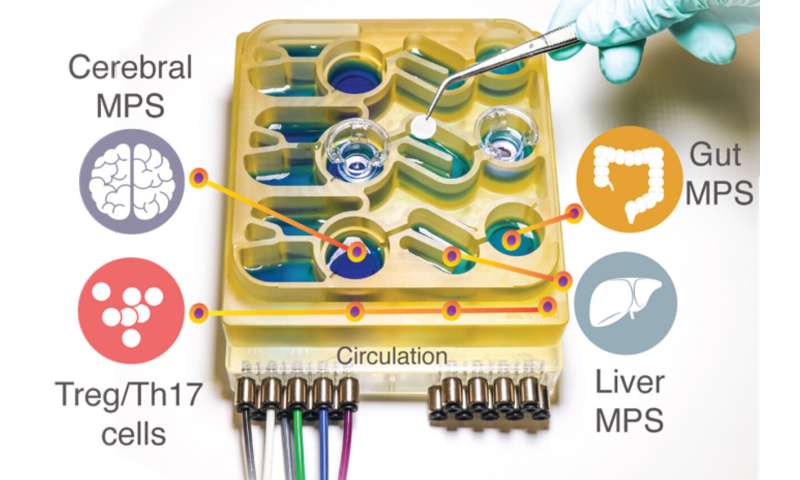
Modellare queste complesse interazioni in animali come i topi è difficile, perché la loro fisiologia è molto diversa da quella umana. Per comprendere meglio l’asse intestino-cervello, i ricercatori del MIT hanno sviluppato un sistema “organi su chip” che replica le interazioni tra cervello, fegato e colon.
Utilizzando questo sistema, i ricercatori sono stati in grado di modellare l’influenza che i microbi che vivono nell’intestino hanno sia sul tessuto cerebrale sano che sui campioni di tessuto derivati da pazienti con malattia di Parkinson. Hanno scoperto che gli acidi grassi a catena corta, prodotti dai microbi nell’intestino e trasportati al cervello, possono avere effetti molto diversi sulle cellule cerebrali sane e malate.
Vedi anche:Il microbioma intestinale influenza i risultati della SLA
“Sebbene gli acidi grassi a catena corta siano ampiamente benefici per la salute umana, abbiamo osservato che in determinate condizioni possono esacerbare ulteriormente alcune patologie cerebrali, come il ripiegamento errato delle proteine e la morte neuronale, correlate al morbo di Parkinson“, afferma Martin Trapecar, postdoc del MIT e autore principale dello studio.
Linda Griffith, Professore della School of Engineering di Teaching Innovation e Professore di ingegneria biologica e ingegneria meccanica e Rudolf Jaenisch, Professore di biologia del MIT e membro del Whitehead Institute for Medical Research del MIT, sono gli autori senior del documento che appare oggi in Science Advances.
La connessione intestino-cervello
Per diversi anni, il laboratorio di Griffith ha sviluppato sistemi microfisiologici, piccoli dispositivi che possono essere utilizzati per far crescere modelli di tessuto ingegnerizzato di diversi organi, collegati da canali microfluidici. “In alcuni casi, questi modelli possono offrire informazioni più accurate sulle malattie umane rispetto ai modelli animali”, afferma Griffith.
In un articolo pubblicato lo scorso anno, Griffith e Trapecar hanno utilizzato un sistema microfisiologico per modellare le interazioni tra il fegato e il colon. In quello studio, hanno scoperto che gli acidi grassi a catena corta (SCFA), molecole prodotte dai microbi nell’intestino, possono peggiorare l’infiammazione autoimmune associata alla colite ulcerosa in determinate condizioni. Gli SCFA, che includono butirrato, propionato e acetato, possono anche avere effetti benefici sui tessuti, inclusa una maggiore tolleranza immunitaria e rappresentano circa il 10% dell’energia che otteniamo dal cibo.
Nel nuovo studio, il team del MIT ha deciso di aggiungere il cervello e le cellule immunitarie circolanti al loro sistema multiorgano. Il cervello ha molte interazioni con il tratto digerente che possono avvenire attraverso il sistema nervoso enterico o attraverso la circolazione di cellule immunitarie, nutrienti e ormoni tra gli organi.
Diversi anni fa, Sarkis Mazmanian, Professore di microbiologia al Caltech, ha scoperto una connessione tra SCFA e morbo di Parkinson nei topi. Ha dimostrato che gli SCFA, prodotti dai batteri mentre consumano fibre non digerite nell’intestino, hanno accelerato la progressione della malattia, mentre i topi allevati in un ambiente privo di germi sono stati più lenti a sviluppare la malattia.
Griffith e Trapecar hanno deciso di esplorare ulteriormente le scoperte di Mazmanian, utilizzando il loro modello microfisiologico. Per farlo, hanno collaborato con il laboratorio di Jaenisch al Whitehead Institute. Jaenisch aveva precedentemente sviluppato un modo per trasformare i fibroblasti dei pazienti con Parkinson in cellule staminali pluripotenti che possono quindi essere indotte a differenziarsi in diversi tipi di cellule cerebrali: neuroni, astrociti e microglia.
Più dell’80% dei casi di Parkinson non può essere collegato a una specifica mutazione genetica, ma il resto ha una causa genetica. Le cellule che i ricercatori del MIT hanno utilizzato per il loro modello di Parkinson sono portatrici di una mutazione che causa l’accumulo di una proteina chiamata alfa sinucleina, che danneggia i neuroni e provoca infiammazione nelle cellule cerebrali. Il laboratorio di Jaenisch ha anche generato cellule cerebrali che hanno questa mutazione corretta, ma sono per il resto geneticamente identiche e provenienti dalle cellule malate dello stesso paziente.
Griffith e Trapecar hanno prima studiato questi due gruppi di cellule cerebrali in sistemi microfisiologici che non erano collegati ad altri tessuti e hanno scoperto che le cellule di Parkinson mostravano più infiammazione rispetto alle cellule sane e corrette. Le cellule di Parkinson avevano anche menomazioni nella loro capacità di metabolizzare i lipidi e il colesterolo.
Effetti opposti
I ricercatori hanno quindi collegato le cellule cerebrali ai modelli di tessuto del colon e del fegato, utilizzando canali che consentono alle cellule immunitarie e ai nutrienti, inclusi gli SCFA, di fluire tra di loro. Hanno scoperto che per le cellule cerebrali sane, l’esposizione agli SCFA è benefica e le aiuta a maturare. Tuttavia, quando le cellule cerebrali derivate da pazienti con Parkinson sono state esposte agli SCFA, gli effetti benefici sono scomparsi. Invece, le cellule hanno sperimentato livelli più elevati di ripiegamento errato delle proteine e morte cellulare.
Questi effetti sono stati osservati anche quando le cellule immunitarie sono state rimosse dal sistema, portando i ricercatori a ipotizzare che gli effetti siano mediati dai cambiamenti nel metabolismo dei lipidi.
“Sembra che gli acidi grassi a catena corta possano essere collegati a malattie neurodegenerative influenzando il metabolismo dei lipidi piuttosto che influenzare direttamente una certa popolazione di cellule immunitarie”, afferma Trapecar. “Ora l’obiettivo per noi è cercare di capire tutto questo”.
I ricercatori hanno anche in programma di modellare altri tipi di malattie neurologiche che possono essere influenzate dal microbioma intestinale. “Questi risultati offrono supporto all’idea che i modelli di tessuto umano potrebbero fornire informazioni che i modelli animali non possono fornire”, dice Griffith che ora sta lavorando a una nuova versione del modello che includerà micro vasi sanguigni che collegano diversi tipi di tessuto, consentendo ai ricercatori di studiare come il flusso sanguigno tra i tessuti li influenza.
Fonte:Science