Immunoterapia-Immagine Credit Public Domain.
Asgard Therapeutics sta portando avanti l’immunoterapia del cancro con una piattaforma di riprogrammazione cellulare diretta, pronta all’uso, che trasforma le cellule tumorali in cellule dendritiche immunogeniche che inducono una potente immunità antitumorale.
L’immunoterapia del cancro ha dimostrato efficacia in alcuni sottotipi di cancro, ma spesso non riesce a fornire benefici clinicamente significativi ai pazienti perché i loro tumori sono scarsamente immunogenici. Uno degli obiettivi principali di molti approcci immunoterapici è trasformare tali “tumori freddi” in “tumori caldi” che suscitano una risposta immunitaria forte e sostenuta per eliminare le cellule maligne. Asgard Therapeutics, con sede a Lund, in Svezia, sta sviluppando un nuovo modo di riscaldare il microambiente tumorale (TME) riprogrammando le cellule tumorali in modo che diventino cellule dendritiche presentanti l’antigene (DC) e attivano le cellule T citotossiche contro se stesse.
La piattaforma tecnologica di Asgard, nata dalla ricerca svolta presso l’Università di Lund, utilizza un vettore virale per fornire tre geni che codificano i fattori di trascrizione che ricollegano le firme trascrizionali ed epigenetiche all’interno delle cellule trasdotte. Questo ricablaggio trasforma le cellule in DC, in particolare DC convenzionali di tipo 1 (cDC1), che possono presentare efficacemente antigeni tumorali e indurre risposte immunitarie antitumorali. La piattaforma è pronta all’uso e, allo stesso tempo, induce una risposta immunitaria personalizzata basata sul profilo antigenico specifico del tumore di ciascun paziente (Fig. 1).
Quando consegnati nel tumore, i fattori di trascrizione codificati nel veicolo di consegna del gene di Asgard, sono in grado di riprogrammare le cellule tumorali, trasformandole in cDC1 funzionali, che sono più efficaci di altri sottotipi DC nella presentazione incrociata degli antigeni e inducendo cellule T specifiche dell’antigene. I cDC1 reclutano anche cellule T citotossiche nei tumori e secernono citochine e chemochine per creare un TME pro-infiammatorio che trasforma i tumori da freddi a caldi.
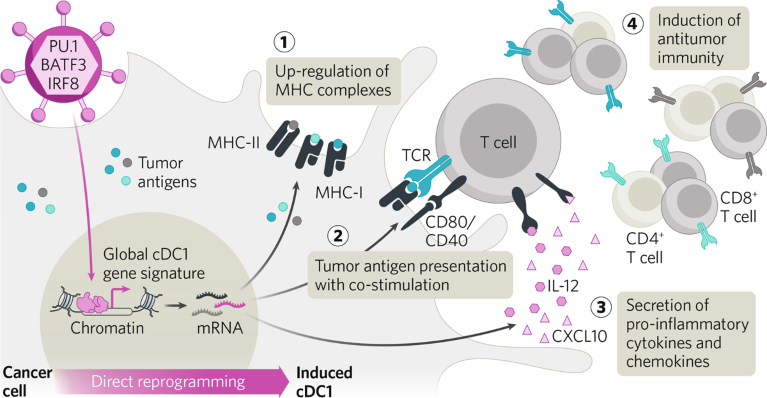
Figura 1 | L’approccio di riprogrammazione cellulare diretta di Asgard. Un vettore sovraesprime i fattori di trascrizione che riprogrammano le cellule tumorali in cellule dendritiche convenzionali di tipo 1 (cDC1). Le cDC1 indotte presentano antigeni tumorali (neo) carichi di MHC ( 1 ) con segnali costimolatori ( 2 ) e secernono citochine e chemochine ( 3 ), inducendo risposte policlonali delle cellule T e immunità antitumorale ( 4 ). MHC, complesso maggiore di istocompatibilità.
La presenza di cDC1 nei tumori è importante per una buona prognosi del cancro, così come una risposta agli inibitori del checkpoint immunitario (ICI). Tuttavia, i cDC1 sono piuttosto rari e attualmente non è possibile generare una popolazione pura di cDC1 per la terapia. Fortunatamente, l’elevata specializzazione funzionale delle cDC1 significa che poche di queste cellule devono essere presenti nei tumori, circa lo 0,1%, per ottenere un’efficace immunità antitumorale.
Ingegneria dei tumori
La riprogrammazione cellulare diretta induce caratteristiche funzionali simili a cDC1 nelle cellule trasdotte entro 3 giorni dall’espressione dei fattori di trascrizione e il processo è completo dopo 9 giorni, senza alcuna transizione attraverso intermedi staminali o progenitrici. Sebbene i cDC1 siano naturalmente di breve durata, aumentano l’infiltrazione di cellule T CD8 + nel TME e creano risposte immunitarie di lunga durata a livello sistemico.
La riprogrammazione cellulare diretta in vivo offre numerosi vantaggi rispetto ad altri approcci immunoterapeutici. È più economica, più scalabile e pone meno sfide logistiche rispetto alle terapie cellulari autologhe e allogeniche, che richiedono modifiche cellulari ex vivo costose e dispendiose in termini di tempo. Inoltre, la terapia cellulare e le strategie di sostituzione genica devono stabilire l’espressione e l’attecchimento a lungo termine del trattamento erogato. Al contrario, gli effetti a lungo termine della riprogrammazione diretta in vivo per indurre la presentazione professionale dell’antigene si basano sulla memoria immunologica, che elude i problemi di sostenere l’espressione o l’attecchimento.
Asgard ha confermato che le cellule riprogrammate direttamente con la suite selezionata di fattori di trascrizione ricapitolano le caratteristiche chiave dei cDC1 presenti in natura, e questo è stato dimostrato in più di 80 tipi di cellule, comprese le cellule tumorali umane prelevate da biopsie. Quando riprogrammate, le cellule tumorali perdono il loro potenziale tumorigenico e acquisiscono un fenotipo specifico per cDC1 e un profilo trascrizionale indipendente dal tipo di origine del cancro umano. È importante sottolineare che i cDC1 indotti mostrano una forte sovraregolazione della presentazione dell’antigene (MHC di classe I e II) e delle molecole co-stimolatorie, nonché la secrezione di citochine pro-infiammatorie, i tre segnali necessari per un’efficiente attivazione delle cellule T. Inoltre, le cDC1 indotte sono in grado di caricare e presentare i propri antigeni tumorali endogeni sull’MHC,
Nei modelli murini singenici, i cDC1 riprogrammati sono in grado di indurre effetti antitumorali locali, con conseguente aumento delle cellule T citotossiche antigene-specifiche nei tumori, nonché sistemicamente nel sangue e nei linfonodi, portando a una crescita tumorale notevolmente più lenta e a una sopravvivenza prolungata.
Vedi anche:Cancro: alleviare la tossicità dell’immunoterapia
Costruire per il futuro dell’immunoterapia
Asgard sta attualmente ottimizzando la somministrazione in vivo della sua immunoterapia di riprogrammazione cellulare diretta e sta conducendo studi per dimostrare l’effetto abscopale e l’immunità sistemica. L’azienda sta inoltre valutando gli effetti della riprogrammazione cellulare in combinazione con gli ICI. Questi studi apriranno la porta per la fase successiva di raffinamento dei suoi processi per la chimica, la produzione e i controlli (CMC) e le buone pratiche di fabbricazione (GMP) mentre si eseguono gli studi di tossicità finale di dosaggio, farmacologia di sicurezza e buona pratica di laboratorio (BPL) in preparazione per una nuova domanda di droga sperimentale (IND).
La società prevede di iniziare i primi studi sull’uomo nel 2025, con il melanoma e il cancro della testa e del collo come indicazioni prioritarie, data la loro accessibilità alla somministrazione intratumorale, l’elevato carico di mutazioni tumorali, la risposta incompleta agli ICI, l’elevata efficienza di riprogrammazione e l’elevata potenziale di mercato.
Asgard dà il benvenuto a potenziali nuovi partner, inclusi investitori e aziende farmaceutiche che vorrebbero unirsi al prossimo balzo in avanti dell’immunoterapia contro il cancro.
Fonte:Nature