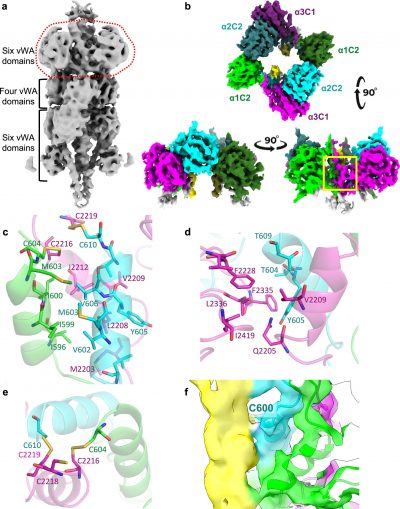
Distrofia muscolare-immagine: struttura della regione C-terminale all’interno della microfibrilla tissutale. Crediti: Nature Communications.
Gli scienziati dell’Università di Manchester hanno mappato le mutazioni nelle minuscole catene proteiche che causano un sottotipo di distrofia muscolare. Pubblicato sulla rivista Nature Communications, lo studio fornisce una panoramica approfondita del sottotipo di distrofia muscolare noto collettivamente come distrofia correlata al collagene VI, o COL6-RD in breve.
Il team è il primo in assoluto a determinare la struttura ad alta risoluzione del collagene VI, una delle reti di molecole proteiche che conferiscono ai nostri tessuti resistenza meccanica e la capacità di allungarsi e piegarsi.
Chiamata matrice extracellulare, la rete proteica consente inoltre alle cellule di percepire l’ambiente circostante e di comunicare tra loro in risposta alle forze meccaniche.
La COL6-RD, che comprende la distrofia muscolare congenita di Ullrich (UCMD) e la miopatia di Bethlem (BM), può causare una serie di sintomi tra cui debolezza muscolare, contratture articolari, diminuzione del tono muscolare e debolezza dei muscoli respiratori.
È uno dei numerosi sottotipi di distrofia muscolare; tra gli altri c’è la più diffusa distrofia di Duchenne, causata dalla mutazione di un’altra proteina, per la quale gli scienziati stanno sviluppando terapie geniche.
Tuttavia, finora non sono state sviluppate terapie equivalenti per COL6-RD.
I collageni sono le proteine della matrice extracellulare più abbondanti e formano lunghe fibre, molte volte più piccole di un capello umano, chiamate microfibrille.
Il collagene VI forma un tipo di microfibrilla, assumendo l’aspetto di una grande struttura a forma di perla, composta da tre catene proteiche separate che si attorcigliano e si ripiegano insieme.
La ricerca ha richiesto agli scienziati di sviluppare piccoli frammenti di collagene VI, che hanno chiamato mini-collageni. I mini-collageni saranno strumenti utili per studiare o persino curare le malattie associate alle mutazioni del collagene VI .
L’autore principale dello studio, Clair Baldock, Professore di biochimica all’Università di Manchester, ha affermato: “È estremamente importante capire dove si trovano le mutazioni nelle minuscole catene proteiche chiamate collagene VI che causano un sottotipo di distrofia muscolare, per aiutare nella progettazione di trattamenti futuri. Utilizzando una tecnica chiamata microscopia criogenica elettronica, che può ingrandire il collagene VI centinaia di migliaia di volte, siamo stati in grado di determinare l’organizzazione delle parti del collagene VI e di mappare le mutazioni della malattia. Ciò offre agli scienziati l’opportunità di progettare farmaci che colpiscono specificamente le mutazioni, concentrandosi solo su ciò che è danneggiato”.
Leggi anche:Distrofia muscolare di Duchenne: nuovo approccio migliora la funzione neuromuscolare
Spiegano gli autori:
“Il collagene VI collega la superficie cellulare alla matrice extracellulare per fornire resistenza meccanica alla maggior parte dei tessuti dei mammiferi ed è collegato a patologie umane tra cui distrofia muscolare, fibrosi, malattie cardiovascolari e osteoartrite. Il collagene VI si assembla da eterotrimeri di tre diverse catene α in microfibrille, ma ci sono molte lacune nella nostra conoscenza del processo di assemblaggio molecolare. In questo articolo, determiniamo le strutture sia dei costrutti eterotrimerici di mini-collagene VI che delle microfibrille di collagene VI, provenienti da tessuti di mammifero, utilizzando la microscopia elettronica criogenica. Queste strutture rivelano una regione coiled coil ricca di cisteina coinvolta nella trimerizzazione e nell’assemblaggio delle microfibrille. Inoltre, le nostre strutture mostrano che mutazioni patogene sono localizzate in siti di interazione coinvolti in diverse fasi dell’assemblaggio del collagene VI, dalla regione trimerica coiled coil che media l’eterotrimerizzazione, a cluster di mutazioni nella regione a tripla elica coinvolta nella formazione delle microfibrille. La nostra struttura microfibrillare fornisce un modello per comprendere l’assemblaggio sopramolecolare e offre una piattaforma per la progettazione razionale di terapie per le patologie del collagene VI”.
Ha aggiunto Clair Baldock: “Siamo il primo gruppo a determinare la struttura ad alta risoluzione del collagene VI; finora, nessuno era riuscito a mostrare la posizione di queste mutazioni sulla struttura del collagene VI. Si tratta di un passo importante nel percorso verso la scoperta di metodi per curare questi tipi di distrofia muscolare e darà impulso all’accelerazione delle scoperte scientifiche in questo settore. Ci auguriamo che la nostra struttura fornisca informazioni essenziali per aiutare la comunità scientifica a sviluppare trattamenti, come la terapia genica, per il collagene VI-RD. Ciò offre una certa spera nza alle persone affette da distrofia muscolare: un giorno saranno disponibili trattamenti in grado di migliorare la loro qualità di vita e aiutarle a rimanere attive e indipendenti“.
Fonte: Nature Communications