Immagine: Tau Protein. Credito: Jawahar Swaminathan e personale MSD presso l’Istituto europeo di bioinformatica.
Un team di ricercatori, in collaborazione con il MRC Laboratory of Molecular Biology nel Regno Unito e la Indiana University School of Medicine negli Stati Uniti, ha determinato la struttura dei filamenti tau in pazienti con la malattia di Pick.
La malattia di Pick è un raro tipo di demenza senile che colpisce i lobi frontali del cervello e causa problemi di linguaggio come afasia, difficoltà comportamentali e alla fine la morte. Fu descritta per la prima volta dal neurologo e psichiatra ceco Arnold Pick nel 1892. In alcuni testi medici più antichi, la malattia di Pick viene usata in modo intercambiabile con la “demenza frontotemporale“, ma nella medicina moderna, la malattia di Pick è considerata una delle tre cause molto specifiche di demenza fron totemporale.
Lo studio è stato pubblicato sulla rivista Nature.
Le malattie neurologiche sono spesso caratterizzate da proteine tau misfolded nel cervello che portano alla distruzione dei neuroni. La ricerca precedente ha portato alla scoperta che ci sono sei proteine tau nel cervello umano e tutte sono essenziali per la normale attività neuronale. Per ragioni sconosciute, queste proteine a volte si ripiegano in modo improprio portando a un effetto a catena in cui più si deformano e più, tali cascate definite filamenti portano alla degenerazione dei neuroni e, nella maggior parte dei pazienti, alla morte neurologica.
I ricercatori hanno lavorato per determinare la struttura delle misfolds coinvolte in tali malattie, sperando di capire perché le proteine si mischiano e magari trovano anche un modo per impedire che cio’ accada. Recentemente, i ricercatori hanno annunciato di aver determinato la struttura dei filamenti tau associati alla malattia di Alzheimer. In questo nuovo sforzo, ora hanno fatto lo stesso con la malattia di Pick.
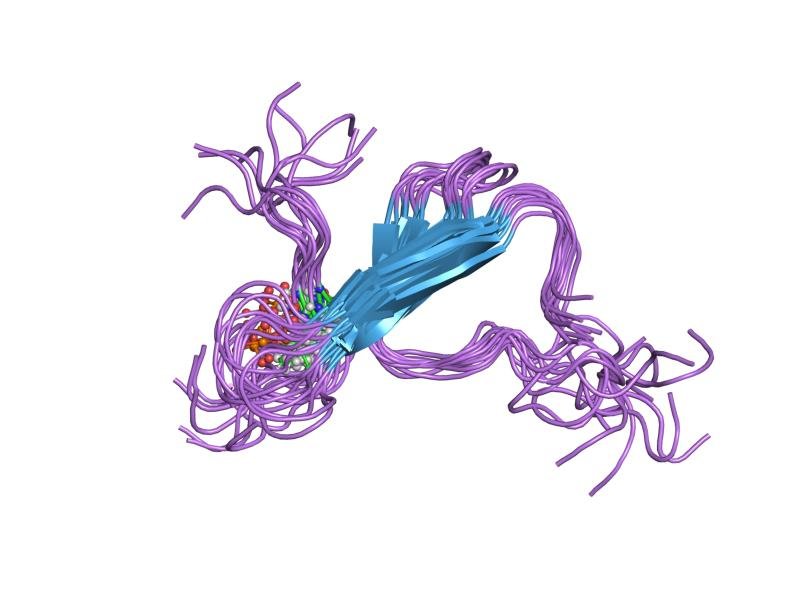
Le proteine Tau possono avere una struttura composta da tre o quattro ripetizioni di legatura di microtubuli e i filamenti possono avere una o entrambe le strutture. I ricercatori hanno scoperto che tali filamenti associati alla malattia di Pick avevano solo tre ripetizioni e che erano di forma nuova e distinti da quelli trovati in pazienti con malattia di Alzheimer. Per lo studio è stata utilizzata la criomicroscopia elettronica, in cui i campioni sono stati raffreddati a temperature criogeniche e quindi esaminati con un microscopio elettronico. La scoperta offre prove a sostegno di una teoria che suggerisce che le differenze nelle malattie neurologiche siano probabilmente dovute a differenze nelle strutture dei filamenti.
Astratto
“L’assemblaggio ordinato di proteine tau in inclusioni filamentose anomale è alla base di molte malattie neurodegenerative umane. I grovigli Tau sembrano diffondersi attraverso specifiche reti neurali in ogni malattia, con filamenti corti che hanno la più grande attività di semina. L’abbondanza di inclusioni tau è fortemente correlata con i sintomi della malattia. Sei isoforme di tau sono espresse nel normale cervello umano adulto: tre isoforme con quattro ripetizioni di legatura dei microtubuli ciascuna (4R tau) e tre isoforme che mancano della seconda ripetizione (3R tau). In varie malattie, i filamenti di tau possono essere composti da 3R o 4R tau, o da entrambi. I filamenti di Tau hanno distinte distribuzioni cellulari e neuroanatomiche con differenze morfologiche e biochimiche che suggeriscono che potrebbero essere in grado di adottare conformazioni molecolari specifiche della malattia. Tali conformzioni possono dare origine a diversi fenotipi neuropatologici, che ricordano i ceppi di prioni. Tuttavia, le strutture sottostanti non sono note. Usando la crio-microscopia elettronica, abbiamo recentemente riportato le strutture dei filamenti tau da pazienti con malattia di Alzheimer, che contengono sia ta 3R che 4R tau. Qui determiniamo le strutture dei filamenti tau dei pazienti con la malattia di Pick, una malattia neurodegenerativa caratterizzata da demenza frontotemporale. I filamenti sono costituiti da residui Lys254-Phe378 di 3R tau, che sono piegati in modo diverso dai filamenti tau nella malattia di Alzheimer, stabilendo l’esistenza di conformatori di tau assemblati. La piega tau osservata nei filamenti dei pazienti con la malattia di Pick spiega l’incorporazione selettiva di 3R tau nei corpi Pick, e le differenze nella fosforilazione rispetto ai filamenti tau della malattia di Alzheimer. I nostri risultati mostrano come tau possa adottare pieghe distinte nel cervello umano in diverse malattie, un passo essenziale per comprendere la formazione e la propagazione di conformatori molecolari”.