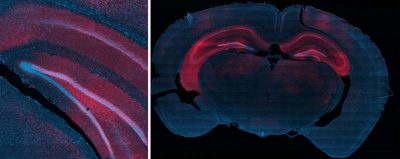
Crisi epilettiche-immagine: sinistra) Sezione cerebrale che mostra il rilascio mirato di geni nell’ippocampo ventrale, guidato con precisione dagli ultrasuoni focalizzati. (A destra) Sezione cerebrale che mostra l’espressione genica ad alta risoluzione spaziale ottenuta in tutto l’ippocampo bilaterale. Crediti: Laboratorio di Neuroingegneria Non Invasiva / Rice University
I bioingegneri della Rice University hanno creato un metodo non chirurgico per silenziare un circuito cerebrale correlato alle crisi epilettiche in un modello animale. Il team ha utilizzato ultrasuoni focalizzati a bassa intensità per aprire brevemente la barriera emato-encefalica (BEE) nell’ippocampo, ha somministrato una terapia genica ingegnerizzata solo a quella regione e in seguito ha attivato un “interruttore dimmer” a richiesta con un farmaco orale.
La ricerca, pubblicata sulla copertina di ACS Chemical Neuroscience, dimostra che una singola procedura mirata può modulare una specifica regione cerebrale senza impattare sulle aree cerebrali non bersaglio.
“Molte malattie neurologiche sono causate da cellule iperattive in una particolare area del cervello”, ha affermato Jerzy Szablowski, Professore associato di bioingegneria e membro della Rice Neuroengineering Initiative, a capo dello studio. “Il nostro approccio indirizza la terapia dove è necessaria e consente di controllarla quando serve, senza intervento chirurgico e senza un impianto permanente”.
Come il metodo ATAC agisce sui circuiti cerebrali
Il lavoro si basa su quasi un decennio di innovazione da parte di Szablowski e del suo team. Il metodo chemiogenetico acusticamente mirato (ATAC) del gruppo fonde ultrasuoni, terapia genica e chemiogenetica – una tecnica che dota neuroni selezionati di recettori ingegnerizzati in modo che possano essere attivati o silenziati da un farmaco specifico – in un unico strumento che consente un controllo preciso dei circuiti cerebrali senza intervento chirurgico.
Nella procedura ATAC, i ricercatori hanno prima iniettato microscopiche bolle piene di gas nel flusso sanguigno. Quando onde ultrasoniche a bassa intensità sono state indirizzate all’ippocampo , le microbolle hanno oscillato delicatamente contro le pareti dei vasi sanguigni, creando aperture temporanee su scala nanometrica nella BBB. Questi pori erano centinaia di volte più piccoli delle cellule del sangue, impedendone così il passaggio, ma sufficientemente grandi da consentire ai vettori di somministrazione genica ingegnerizzati, sviluppati dal laboratorio Szablowski, di entrare nel tessuto cerebrale bersaglio. I pori si sono chiusi naturalmente nel giro di poche ore, lasciando intatta la BBB.
I vettori ingegnerizzati contenevano istruzioni per costruire un recettore chemiogenetico inibitorio, una sorta di “interruttore dimmer” molecolare che fa sì che i neuroni rispondano a un farmaco somministrato in seguito per “silenziare” l’attività che induce le crisi convulsive.
Immagine: due immagini ingrandite delle regioni dell’ippocampo che mostrano l’elevata efficienza di trasduzione del vettore somministrato. Crediti: Laboratorio di Neuroingegneria Non Invasiva / Rice University
“Colpendo con precisione l’ippocampo, possiamo attenuare l’iperattività dove serve e lasciare intatto il resto del cervello”, ha affermato Honghao Li, uno studente di dottorato in bioingegneria alla Rice e uno dei primi autori dello studio.
I risultati confermano che l’ATAC può ottenere un controllo preciso sui circuiti cerebrali bersaglio utilizzando una procedura minimamente invasiva e un semplice farmaco sistemico. Poiché sia l’apertura della barriera ematoencefalica mediante ultrasuoni focalizzati sia il trasferimento genico tramite vettori virali stanno già avanzando negli studi clinici, il metodo potrebbe accelerare lo sviluppo di trattamenti mirati per l’epilessia e altri disturbi neurologici.
Abstract:
“Molte malattie neurologiche e psichiatriche sono caratterizzate da un’attività neuronale patologica. I trattamenti attuali prevedono farmaci, interventi chirurgici e dispositivi impiantabili per modulare o rimuovere la regione interessata. Tuttavia, nessuno di questi metodi può essere contemporaneamente non chirurgico e possedere specificità per sito e tipo cellulare. In questo caso, applichiamo un approccio di neuromodulazione non chirurgico chiamato Chemogenetica Acusticamente Mirata, o ATAC, per aumentare la soglia convulsiva. L’approccio ATAC utilizza ultrasuoni focalizzati multipunto per aprire transitoriamente la barriera emato-encefalica dell’intero ippocampo (HPC) e trasdurre neuroni piramidali con recettori accoppiati a proteine G ingegnerizzati per inibirne l’attività. Per esprimere i recettori ingegnerizzati nell’HPC di topo, abbiamo utilizzato un vettore virale recentemente ingegnerizzato, ottimizzato per il rilascio genico al cervello tramite ultrasuoni, AAV.FUS.3. In un modello di crisi epilettica da fluorotilo nel topo, abbiamo dimostrato un rilascio genico efficace in tutto l’HPC, con una significativa inibizione dell’attività neuronale, come evidenziato da un aumento della soglia convulsiva. Infine, abbiamo confrontato questi effetti con un farmaco prescritto clinicamente che agisce senza precisione spaziale”.
Implicazioni più ampie e direzioni future
L’esperimento sull’ippocampo segna una pietra miliare per il gruppo di Szablowski, che in precedenza aveva dimostrato come somministrare terapie geniche a grandi volumi cerebrali, piccole regioni cerebrali mirate e persino singole connessioni neuronali.
Gli ultrasuoni focalizzati possono anche essere utilizzati per recuperare segnali molecolari da specifiche regioni cerebrali: una tecnica correlata del laboratorio Szablowski, nota come recupero di marcatori tramite insonazione (REMIS), può rilasciare proteine ingegnerizzate o naturali solo dalla regione insonata nel flusso sanguigno, consentendo ai ricercatori di monitorare l’attività genica senza indagini invasive. La tecnica ha dato origine a una sperimentazione clinica con i partner del Texas Medical Center, tra cui ricercatori del Baylor College of Medicine e dell’MD Anderson Cancer Center dell’Università del Texas.
Leggi anche:Semi di cumino ispirano nuovi farmaci contro le crisi epilettiche
“Queste tecnologie si completano a vicenda”, ha affermato Szablowski. “Gli ultrasuoni ci permettono di somministrare la terapia, controllare i neuroni desiderati e quindi misurarne gli effetti nel circuito specifico che abbiamo preso di mira. Il nostro obiettivo è costruire una piattaforma in grado di raggiungere qualsiasi regione cerebrale in modo sicuro, somministrare qualsiasi carico genetico con precisione e consentire ai medici di controllarlo su richiesta. Questo tipo di versatilità potrebbe cambiare il nostro modo di concepire lo sviluppo di terapie cerebrali“.
Fonte: ACS Chemical Neuroscience