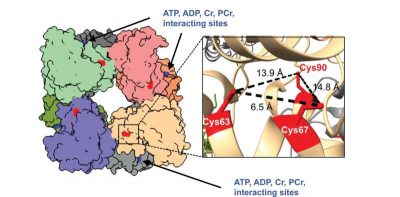
Cardiomiopatia ipertrofica-immagine: come è costruito il “sistema di trasporto energetico” del cuore. L’immagine mostra la forma tridimensionale della creatina chinasi mitocondriale. Crediti: Anton Xu et al., Circulation
La cardiomiopatia ipertrofica (HCM) è la cardiopatia ereditaria più comune. Causa l’ispessimento del ventricolo sinistro, una contrazione eccessiva del muscolo cardiaco e un sovraccarico di lavoro. Questo ulteriore sforzo esercita una pressione sulle centrali energetiche delle cellule, i mitocondri, e può aumentare il rischio di pericolose aritmie cardiache. La creatinchinasi svolge un ruolo chiave nel mantenimento dell’equilibrio tra consumo e produzione di energia (omeostasi energetica). Questo enzima aiuta il cuore a riciclare rapidamente l’energia in modo che ogni battito cardiaco riceva l’energia di cui ha bisogno.
Un team del Dipartimento di Ricerca Traslazionale del Centro per l’Insufficienza Cardiaca Integrale di Würzburg (CHFC) ha collaborato con partner nazionali e internazionali per studiare il ruolo della creatinchinasi nella cardiomiopatia ipertrofica (HCM).
I risultati sono stati pubblicati sulla rivista Circulation.
Le forti contrazioni cardiache aumentano il perossido di idrogeno nei mitocondri: la creatina chinasi viene disattivata
“Abbiamo scoperto che il sovraccarico del muscolo cardiaco induce i mitocondri a produrre più perossido di idrogeno. Questa molecola reattiva dell’ossigeno è normalmente presente in piccole quantità come sottoprodotto, ma una quantità eccessiva può stressare o danneggiare le cellule nel tempo. Nella cardiomiopatia ipertrofica (HCM), lo stress ossidativo disattiva la creatina chinasi in due siti importanti: nei filamenti, dove viene generata la forza muscolare e nei mitocondri, dove viene prodotta energia“, spiega Anton Xu, dottorando presso l’CHFC e primo autore dello studio. “Ciò significa che quando la creatina chinasi è disattivata, il cuore non riesce a mantenere un apporto costante di energia dove è più necessaria. Questo aumenta il rischio di aritmia cardiaca e causa ulteriore stress“.
Gli inibitori della miosina riducono le contrazioni e quindi proteggono la creatina chinasi dall’inattivazione e prevengono le aritmie cellulari
Il team ha osservato questi cambiamenti nelle biopsie cardiache di pazienti con HCM e ha confermato sia la causa che l’effetto positivo di un inibitore della miosina in diversi modelli di laboratorio. Gli inibitori della miosina riducono l’interazione tra le proteine contrattili actina e miosina, aiutando il muscolo cardiaco a rilassarsi meglio e a contrarsi con meno forza.
“Nei nostri studi, abbiamo osservato che, sotto l’effetto dell’inibitore della miosina, i livelli di perossido di idrogeno diminuivano, la funzionalità della creatinchinasi veniva mantenuta e le aritmie cardiache si riducevano“, riferisce il Dott. Vasco Sequeira, ultimo autore dello studio. “I nostri risultati suggeriscono quindi che i trattamenti che riducono il carico di lavoro sul cuore e limitano lo stress ossidativo possono contribuire a ripristinare l’equilibrio energetico e migliorare i risultati del trattamento nella cardiomiopatia ipertrofica“.
Leggi anche:Cardiomiopatia ipertrofica: esame del sangue previene la morte improvvisa
Osservazione dei motori della miosina nel cuore in tempo reale durante ogni battito cardiaco
Nella fase successiva, il team si concentrerà su una forma avanzata di cardiomiopatia: la cardiomiopatia ipertrofica ostruttiva (HOCM). In questa malattia, un restringimento del tratto di efflusso del ventricolo sinistro causa un’ulteriore resistenza al flusso sanguigno dal cuore. Ciò significa che il cuore deve lavorare ancora di più a ogni battito.
Insieme ai partner del Centro Nazionale Cerebrale e Cardiovascolare di Osaka, i ricercatori di Würzburg mirano a sviluppare modelli animali più realistici. Utilizzando un sistema a raggi X ad alta risoluzione appositamente modificato, saranno quindi in grado di osservare i minuscoli motori miosinici del cuore, ovvero le macchine molecolari responsabili della contrazione, in tempo reale durante ogni battito cardiaco presso l’Istituto Giapponese di Ricerca sulle Radiazioni di Sincrotrone Spring 8 di Harima.
“Questo ci offre una visione senza precedenti di quanto duramente lavora il cuore, battito dopo battito, e ci consente di studiare quanto bene i vasi sanguigni più piccoli riforniscono di sangue il muscolo cardiaco e quanto efficacemente le cellule producono e trasportano energia“, spiega Sequeira con entusiasmo.
Leggi anche:
Sviluppo di parametri per identificare i pazienti che trarranno beneficio dal trattamento
Per riflettere meglio la realtà, il team studierà anche lo stress metabolico, come gli effetti negativi di una dieta ricca di grassi. Successivamente, esaminerà anche se la riduzione dello sforzo ostruttivo sul muscolo cardiaco mediante l’uso di inibitori della miosina ripristini il trasporto di energia del cuore, stabilizzi il suo apporto energetico e riduca il rischio di aritmie cardiache.
“Il nostro obiettivo è sviluppare misurazioni semplici che aiutino i medici a identificare i pazienti affetti da HOCM che hanno maggiori probabilità di trarre beneficio da questi trattamenti di sollievo”, riassume il Prof. Dr. Christoph Maack, responsabile della ricerca traslazionale e portavoce dell’CHFC.
Fonte: Circulation