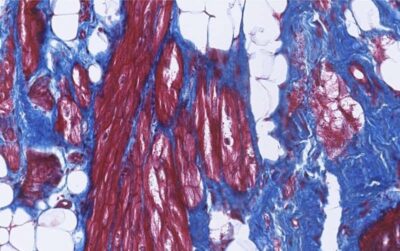
Cardiomiopatia aritmogena-Immagine: macchie di fibrosi (blu) e tessuto adiposo (bianco) nel cuore di un paziente ACM. Le cellule del muscolo cardiaco sono mostrate in rosso. Crediti: Aryan Vink e Petra van der Kraak. Copyright: UMC Utrecht-
Le mutazioni nei geni che formano il desmosoma sono la causa più comune della cardiomiopatia aritmogena (ACM), che colpisce una persona su 2.000-5.000 in tutto il mondo.
I ricercatori del gruppo di Eva van Rooij ora hanno scoperto come una mutazione nel gene desmosomiale plakophilin-2 porti all’ACM. Hanno scoperto che i cambiamenti strutturali e funzionali nei cuori ACM causati da una mutazione della placofilina-2 sono il risultato di una maggiore degradazione delle proteine desmosomiali. I risultati di questo studio, pubblicato su Science Translational Medicine il 22 marzo 2023, approfondiscono la nostra comprensione dell’ACM e potrebbero contribuire allo sviluppo di nuove terapie per questa malattia.
La cardiomiopatia aritmogena è una malattia cardiaca progressiva ed ereditabile per la quale attualmente non esistono trattamenti per arrestarne la progressione. Sebbene i pazienti inizialmente non manifestino alcun sintomo, sono a maggior rischio di aritmie e conseguente arresto cardiaco improvviso. Con il progredire della malattia, nel cuore si formano chiazze di tessuto fibrotico e adiposo che possono portare a insufficienza cardiaca. In questa fase, i pazienti richiedono un trapianto di cuore come trattamento.
Placofilina-2
Più del 50% di tutti i casi di ACM sono causati da una mutazione in uno dei geni desmosomiali, che insieme formano strutture proteiche complesse note come desmosomi. I desmosomi formano “ponti” tra le singole cellule del muscolo cardiaco, consentendo alle cellule di contrarsi in modo coordinato. La maggior parte delle mutazioni desmosomiali che causano la cardiomiopatia aritmogena si verificano in un gene chiamato placofilina-2. Tuttavia, si sa molto poco su come le mutazioni in questo gene portino alla malattia.
Per cambiare questa situazione, il laboratorio Van Rooij ha prima studiato campioni di cuore umano di pazienti con cardiomiopatia aritmogena, portatori di mutazioni nel gene della placofilina-2. “Abbiamo visto livelli più bassi di tutte le proteine desmosomiali e proteine desmosomiali disorganizzate nelle aree fibrotiche dei cuori ACM“, afferma Jenny (Hoyee) Tsui, prima autrice dell’articolo. “Inoltre, il tessuto del muscolo cardiaco 3D in coltura proveniente da un paziente con una mutazione della placofilina-2, non era in grado di continuare a battere a frequenze di stimolazione più elevate, il che ricorda le aritmie osservate in clinica”, ha affermato.
Cardiomiopatia aritmogena nei topi
I ricercatori hanno quindi utilizzato uno strumento genetico chiamato CRISPR/Cas9 per introdurre la mutazione della placofilina-2 umana nei topi per imitare l’ACM. Ciò ha permesso loro di studiare la progressione della malattia in modo più dettagliato. Hanno osservato che i vecchi topi ACM portatori di questa mutazione avevano livelli più bassi di proteine desmosomiali e problemi di rilassamento cardiaco, simili ai pazienti ACM.
Sorprendentemente, i ricercatori hanno scoperto che la mutazione ha abbassato i livelli di proteine desmosomiali anche nei topi giovani e sani il cui cuore si contraeva normalmente. Da ciò hanno concluso che una perdita di proteine desmosomiali potrebbe essere alla base dell’insorgenza di cardiomiopatia aritmogena causata da una mutazione della placofilina-2.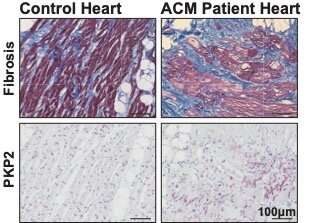
Immagine:Placofilina-2 disorganizzata (PKP2) nelle regioni gravemente fibrotiche del cuore dei pazienti con ACM. I pannelli superiori mostrano il tessuto fibrotico (blu), il tessuto adiposo (bianco) e le cellule del muscolo cardiaco (rosso) del controllo e i cuori dei pazienti ACM. I pannelli inferiori mostrano la localizzazione proteica della placofilina-2 nei cuori di un individuo sano e di un paziente ACM. Credito: Petra van der Kraak. Copyright: UMC Utrecht.
Degradazione delle proteine
I ricercatori sono poi passati a spiegare la perdita di proteine desmosomiali. Per questo hanno studiato sia i livelli di RNA che di proteine nei loro topi ACM. “I livelli di proteine desmosomiali erano più bassi nei nostri topi ACM rispetto ai topi sani di controllo. Tuttavia, i livelli di RNA di questi geni erano invariati. Abbiamo scoperto che questi risultati sorprendenti sono il risultato di una maggiore degradazione proteica nei cuori ACM“, spiega Sebastiaan van Kampen, co-primo autore dell’articolo.
Vedi anche:Cardiomiopatia aritmogena: nuove scoperte sulle cause
Tsui aggiunge: “Quando abbiamo trattato i nostri topi ACM con un farmaco che previene la degradazione delle proteine, i livelli delle proteine desmosomiali sono stati ripristinati. Ancora più importante, i livelli ripristinati delle proteine desmosomiali hanno migliorato la gestione del calcio delle cellule del muscolo cardiaco, che è vitale per la loro normale funzione“.
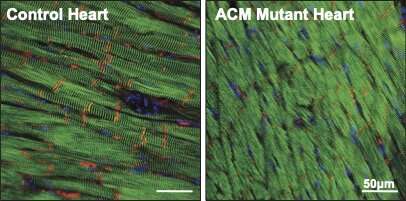
I livelli di placofilina-2 (rosso) sono ridotti nei cuori dei topi ACM rispetto ai topi di controllo sani. Le cellule del muscolo cardiaco sono mostrate in verde, i nuclei delle cellule sono mostrati in blu. Credito: Jenny (Hoyee) Tsui. Copyright: Istituto Hubrecht.
Verso nuove terapie
I risultati di questo studio sollevano nuove conoscenze sullo sviluppo dell’ACM e indicano che la degradazione delle proteine potrebbe essere un obiettivo interessante per le future terapie.
“La degradazione delle proteine si verifica in ogni cellula del nostro corpo ed è cruciale per la funzione di queste cellule. Per superare gli effetti collaterali delle future terapie avremo bisogno di sviluppare farmaci che prevengano la degradazione delle proteine desmosomiali nelle cellule del muscolo cardiaco in particolare“, spiega Eva van Rooij, capogruppo all’Istituto Hubrecht. “Sono quindi necessarie ulteriori ricerche. In futuro, questi nuovi farmaci specifici potrebbero essere potenzialmente utilizzati per arrestare l’insorgenza e prevenire la progressione dell’ACM“.