Cancro allo stomaco-immagine: astratto grafico Credito: Cancer Cell (2025)
Lavorando con un team internazionale di collaboratori, gli scienziati della Columbia University hanno trovato un modo per alterare l’equilibrio di un tipo di globuli bianchi all’interno di un cancro allo stomaco, inducendo il sistema immunitario a riconoscere e attaccare il cancro invece di ignorarlo.
Il lavoro, pubblicato nel numero di agosto di Cancer Cell, fa luce anche sulle funzioni immunitarie che potrebbero essere alla base di molte altre malattie.
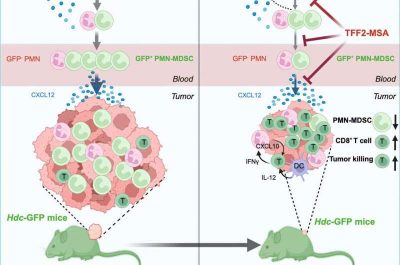
I tumori gastrici stimolano e attraggono una popolazione di cellule immunitarie chiamate neutrofili immunosoppressori, che proteggono il tumore dall’eliminazione da parte del sistema immunitario. Una proteina chiamata CXCR4 è fondamentale per questo processo, reclutando le cellule immunosoppressorie e respingendo i linfociti T che altrimenti attaccherebbero il tumore. Alcuni ricercatori hanno provato a sviluppare farmaci che bloccano l’attività di CXCR4, con risultati contrastanti.
Gli scienziati della Columbia hanno scoperto che una proteina naturale chiamata TFF2 si lega e regola CXCR4. “Abbiamo poi dimostrato che si trattava di un agonista parziale. Quando stimolavamo le cellule che esprimevano CXCR4 con TFF2, osservavamo una segnalazione di basso livello, ma quando aggiungevamo il normale legamento per CXCR4, TFF2 ne bloccava l’attività”, afferma Timothy Wang, MD, primario di malattie digestive ed epatiche alla Columbia e co-responsabile del programma di Biologia dei Tumori e Microambiente presso l’Herbert Irving Comprehensive Cancer Center (HICC).
In altre parole, l’aggiunta di TFF2 potrebbe modificare l’attività di CXCR4 da “alta” a “bassa”, senza disattivarla completamente. Questo, insieme ai risultati di modelli sperimentali di cancro gastrico, suggerisce che TFF2 potrebbe contribuire a modificare l’ambiente immunitario di un tumore, favorendone l’attivazione.
Sfortunatamente, la TFF2 naturale è una proteina a vita breve, che si degrada in un paio di giorni. Il team di Wang ha iniziato a modificarla in vari modi, fino a progettare una versione che dura tre settimane o più in un animale. Nel nuovo lavoro, i ricercatori hanno provato a utilizzare la loro TFF2 modificata per trattare i tumori gastrici in un modello animale della malattia.
“Il peptide TFF2-albumina ha certamente soppresso i neutrofili immunosoppressori e inibito in una certa misura il cancro, ma quando lo abbiamo combinato con altri farmaci, abbiamo ottenuto risposte molto più robuste e un significativo miglioramento della sopravvivenza”, afferma Wang, autore senior del nuovo articolo. L’aggiunta di TFF2-albumina agli attuali trattamenti standard per il cancro gastrico ha prodotto una robusta risposta immunitaria e ha inibito i tumori.
Analizzando il sangue e il midollo osseo degli animali, gli scienziati hanno scoperto che lo sviluppo del tumore provoca un’ampia alterazione nella composizione del sistema immunitario. “Abbiamo osservato che nel cancro gastrico si verifica uno spostamento da quelli che chiamiamo neutrofili buoni a neutrofili cattivi, e che questo fenomeno viene in larga misura corretto dal trattamento con TFF2-albumina negli animali“, afferma Wang.
I dati provenienti da pazienti con cancro gastrico supportano l’idea che il tumore causi anche un’alterazione significativa nella risposta immunitaria complessiva. Attirando i neutrofili immunosoppressori “buoni” nel tumore e fuori dal midollo osseo, dove vengono prodotte le cellule del sangue, il cancro altera il normale equilibrio della produzione di cellule del sangue.
Collaborando con Tonix Pharmaceuticals a Chatham, nel New Jersey, Wang e i suoi colleghi sperano ora di testare la TFF2-albumina in studi clinici. “L’azienda sta attualmente lavorando alla produzione in GMP e ai test di tossicità. Siamo stati in contatto con la FDA e abbiamo ricevuto indicazioni preliminari”, afferma Wang. Aggiunge che il team spera di poter procedere con gli studi clinici in futuro.
Leggi anche:Cancro allo stomaco: effetti chemiopreventivi delle piante autoctone brasiliane
Spiegano gli autori:
“I neutrofili immunosoppressori patologicamente attivati compromettono l’efficacia dell’immunoterapia antitumorale. Il recettore delle chemiochine CXCR4, un regolatore centrale dell’ematopoiesi e della biologia dei neutrofili, rappresenta un bersaglio interessante. In questo studio, abbiamo fuso un agonista parziale secreto di CXCR4, il fattore trefoil 2 (TFF2), con l’albumina sierica di topo (MSA) e abbiamo dimostrato che il peptide TFF2-MSA agisce in sinergia con l’anti-PD-1 per inibire la crescita del tumore primario e le metastasi a distanza e prolungare la sopravvivenza nei modelli murini di cancro gastrico (GC). Utilizzando topi transgenici per istidina decarbossilasi ( Hdc )-GFP per tracciare in vivo le cellule soppressorie derivate da mieloidi polimorfonucleate (PMN-MDSC) , abbiamo scoperto che TFF2-MSA riduce selettivamente i neutrofili immunosoppressori elevati di Hdc -GFP + CXCR4 , potenziando così l’uccisione tumorale mediata dalle cellule T CD8 + con l’anti-PD-1. È importante sottolineare che TFF2-MSA riduce la granulopoiesi midollare, a differenza dell’antagonismo CXCR4 che non conferisce benefici terapeutici. Nei pazienti con GC, livelli elevati di CXCR4 + LOX-1 + neutrofili a bassa densità sono correlati a livelli circolanti di TFF2 inferiori. Nel complesso, i nostri studi introducono una strategia che utilizza l’agonismo parziale di CXCR4 per ripristinare la sensibilità anti-PD-1 prendendo di mira i neutrofili immunosoppressori e la granulopoiesi”.
Lo stesso approccio potrebbe funzionare anche nel cancro del colon, che condivide caratteristiche immunitarie simili, e i risultati suggeriscono anche una strategia più ampia per affrontare le disfunzioni immunitarie croniche che sono alla base di molte altre malattie, che vanno da altri tipi di cancro all’obesità. “Se si riuscisse a trovare un modo per mantenere questi neutrofili immunosoppressori nel midollo osseo quando non si è affetti da un’infezione, si potrebbe aiutare a combattere molte malattie croniche“, afferma Wang.
Fonte: Cancer Cell