Cancro ai polmoni-Immagine: programma di consegna delle cellule LNT di nanoparticelle CRISPR-Cas9 per il trattamento del NSCLC KRAS-mutante. Credito: Science Advances (2024).
L’incidenza del cancro ai polmoni rimane il principale fattore che contribuisce ai tassi di mortalità globale associati al cancro, provocando circa 1,8 milioni di decessi ogni anno. Tra i diversi sottotipi istologici, il cancro del polmone non a piccole cellule (NSCLC) rappresenta circa l’85% dei casi. Sfortunatamente, per la maggior parte dei pazienti affetti da NSCLC avanzato o metastatico, così come per quelli senza obiettivi terapeutici specifici, la sopravvivenza globale mediana rimane bassa anche nonostante l’integrazione di trattamenti ora accessibili. Essendo un promettente strumento di editing genetico, CRISPR-Cas9 ha il potenziale per la diagnosi e il trattamento di vari tumori, infezioni virali e disturbi genetici. A differenza delle terapie tradizionali, CRISPR-Cas9 presenta un netto vantaggio interrompendo in modo permanente i geni cruciali per la sopravvivenza del tumore, aggirando così la necessità di dosaggi ripetitivi. Tuttavia, ci sono sfide che impediscono l’applicazione clinica di CRISPR-Cas9, come la sua degradazione o denaturazione nel flusso sanguigno e la bassa efficienza di rilascio. Inoltre, i principali vettori per la consegna di CRISPR-Cas9, virali e non virali, mancano di capacità di target dei tessuti e di selettività cellulare, presentando un ostacolo critico per l’applicazione in vivo della terapia CRISPR.
Un team di ricercatori dell’Università di Zhejiang, in Cina, ha sviluppato un modo per utilizzare cellule tumorali crio-shock per combattere il cancro ai polmoni. Nel loro studio, pubblicato sulla rivista Science Advances, il gruppo ha utilizzato un trattamento rapido con azoto liquido per modificare le cellule tumorali per trasportare strumenti di modifica genetica per combattere i tumori nei modelli murini.
Come notato dai ricercatori, gli strumenti e le tecniche di editing genomico mediati da CRISPR sono molto promettenti per il trattamento del cancro. Tuttavia, i problemi con il target del tumore e gli effetti collaterali fuori bersaglio ne ostacolano l’efficacia. Per questa nuova ricerca, il team ha trovato un modo per migliorare il target convertendo le cellule tumorali in portatori degli strumenti di editing genetico.
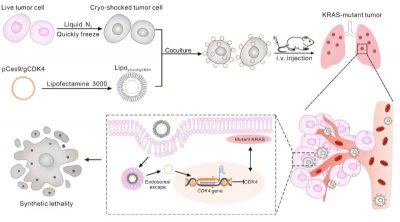
Il lavoro ha coinvolto cellule tumorali crio-shock estratte da un paziente, sottoposte a congelamento rapido utilizzando azoto liquido. Tale congelamento ha rimosso la loro patogenicità preservandone la struttura e, cosa ancora più importante, le funzioni dei recettori superficiali. Dopo il congelamento, il sistema CRISPR-Cas9 è stato caricato nella cellula tumorale sotto shock, che si è fatta strada verso il tumore, dove è stata ablata.
Il team ha testato il proprio approccio raccogliendo campioni di tumore da modelli murini di cancro al polmone, sottoponendoli a crio-shock, caricandoli con il sistema CRISPR-Cas9 e quindi iniettandoli nuovamente nei topi. Le cellule tumorali trattate si sono fatte strada verso il tumore come sperato, dove hanno rilasciato il sistema CRISPR-Cas9, che a sua volta ha abbattuto la chinasi 4 ciclina-dipendente, provocando la morte delle cellule tumorali.
Confrontando l’approccio con quello basato sulla semplice iniezione del sistema CRISPR-Cas9 nei tumori, il gruppo di ricerca ha scoperto che l’approccio più recente offriva una maggiore letalità. Il miglioramento, hanno scoperto i ricercatori, era dovuto a una maggiore precisione nel target. Le cellule tumorali disattivate sono state attratte dal tumore, dove si sono legate alle cellule tumorali attive tramite recettori cellulari, fornendo al sistema di editing genetico l’ accesso diretto alle cellule bersaglio. L’approccio ha inoltre impedito al sistema di editing genetico di funzionare su cellule non cancerose.
Spiegano gli autori:
“Qui, riportiamo una strategia di somministrazione di farmaci CRISPR-Cas9 mirata ai polmoni basata sul doppio target passivo e attivo per abbattere la chinasi 4 ciclina-dipendente ( CDK4 ) nei tumori per indurre letalità sintetica nel NSCLC. La letalità sintetica è definita come l’inattivazione simultanea di due geni che porta alla morte cellulare e la perdita funzionale individuale ha un impatto minimo sulla vitalità cellulare. In generale, le cellule tumorali presentano mutazioni oncogene, che le rendono dipendenti da alcuni geni specifici per il mantenimento dell’omeostasi cellulare. In linea di principio, queste cellule tumorali che portano la mutazione specifica possono essere uccise selettivamente inibendo farmacologicamente un altro gene con un’interazione sintetica letale, mentre alle cellule normali possono essere risparmiati gli effetti dei farmaci perché prive dell’alterazione genetica specifica. Pertanto, la letalità sintetica fornisce una strategia terapeutica promettente per colpire oncogeni non farmacologici attenuando al tempo stesso il danno ai tessuti e alle cellule normali. Finora, alcune interazioni letali sintetiche sono state applicate in studi clinici e terapie. In NSCLC, le mutazioni dell’oncogene del virus del sarcoma del ratto Kirsten ( KRAS ) dominano più del 25% dei distinti sottotipi biologici e clinici. Recentemente, sono state identificate diverse interazioni letali sintetiche in NSCLC con KRAS mutante, fornendo un modo alternativo per potenziare i benefici clinici. La cellula A549 è una tipica cellula NSCLC KRAS-mutante. Dopo la rapida crio-inattivazione con trattamento con azoto liquido (LNT) e l’eliminazione della patogenicità, viene utilizzato qui come vettore per la somministrazione in vivo di CRISPR-Cas9. Beneficiando dell’architettura cellulare intatta e della glicoproteina preservata della superficie cellulare, CD44, questo veicolo cellulare consente un rilascio polmonare altamente mirato attraverso l’intrappolamento passivo da parte dei capillari polmonari, nonché l’interazione e l’adesione cellulare mediate da CD44. I plasmidi pCas9/gCDK4, utilizzati per l’ablazione del CDK4, sono coassemblati con un tipico reagente di trasfezione, la lipofectamina 3000, per formare una nanoformulazione e ancorati alla superficie delle cellule LNT mediante interazioni elettrostatiche. L’ablazione del CDK4 potrebbe indurre la morte delle cellule NSCLC portatrici di mutazioni KRAS, ma non porta alla disfunzione delle cellule normali“.
Leggi anche:Cancro ai polmoni: vaccino LungVax per la prevenzione
Il gruppo di ricerca ha inoltre osservato che il congelamento delle cellule tumorali mediante azoto liquido ha permesso alle cellule di trattenere i loro antigeni, cosa che secondo loro potrebbe rivelarsi utile nello sviluppo di un vaccino come parte del trattamento del cancro.
Fonte:Science Advances