Immagine: a sinistra, il dominio P su norovirus umano si attacca alle cellule umane tramite legame HBGA. IgA anticorpo umano interferisce con questo attaccamento bloccando fisicamente il sito di riconoscimento HBGA sul dominio P. Per gentile concessione di S. Shanker, BVV Prasad e M. Estes
I Norovirus sono virus a singolo filamento di RNA, appartenenti alla famiglia dei Caliciviridae e responsabili della patogenesi infettiva di gastroenteriti di origine alimentare.
Un team di scienziati provenienti dal Baylor College of Medicine e della Vanderbilt University Medical Center hanno individuato un meccanismo attraverso il quale anticorpi umani bloccano il norovirus. Lo studio, che appare oggi nei Proceedings of the National Academy of Sciences, apre la possibilità di sviluppare agenti terapeutici contro questo virus che causa la morte di circa 200.000 bambini ogni anno.
“Alcune persone infettate con norovirus non si ammalano.Volevamo capire perchè e come funzionano questi anticorpi umani di protezione”, ha detto l’autore senior dello studio Dr. BV Venkataram Prasad, Prof. di Virologia presso il Baylor College of Medicine .
I ricercatori hanno proiettato e isolato anticorpi dal sangue umano e hanno scoperto che la maggior protezione dal virus derivava da anticorpi IgA, un anticorpo principalmente coinvolto nella immunità intestinale.
Secondo i Centers for Disease Control and Prevention, il norovirus è la principale causa di malattie di origine alimentare. Il virus entra nel corpo nascosto nel cibo contaminato, viaggia attraverso il sistema digestivo e infetta lo strato superiore della cellule, le cellule epiteliali del piccolo intestino. Per entrare nelle cellule epiteliali il virus si lega alle molecole di glicani che sono polisaccaridi (carboidrati complessi) che, insieme con le proteine o i lipidi presenti nelle membrane cellulari, costituiscono glicoproteine e i glicolipidi di membrana sulla superficie delle cellule.
“L’attacco iniziale è molto importante per il virus”, ha detto Prasad. “E’ come bussare alla porta e poi la porta si apre e il virus può entrare all’interno delle cellule”.
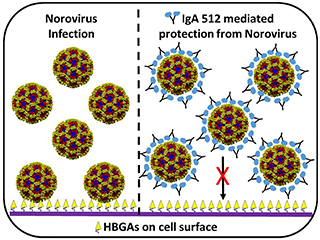
Le cellule epiteliali hanno una copertura di glicani di spessore di tipi diversi, ma i norovirus sembrano legarsi selettivamente a un particolare gruppo di glicani, gli antigeni dei gruppi misto-sangue o HBGA, che determinano anche il nostro tipo di sangue. Diversi ceppi di norovirus interagiscono con diversi tipi di HBGAs.
“Il sito sulle particelle di norovirus che si lega a HBGA si trova in una regione del virus chiamata “dominio P”.
Gli scienziati hanno usato la cristallografia a raggi X per determinare la struttura tridimensionale delle molecole purificate in forma di cristalli. I cristalli sono strutture simmetriche che producono modelli di diffrazione simmetrica quando irradiati con raggi X. Gli scienziati hanno usato i modelli di diffrazione simmetrica a raggi X per ottenere molecole in 3-D.
“La parte parte più difficile di questo progetto è stata quella di ottenere una buona qualità di diffrazione dei cristalli pronti per l’analisi cristallografica a raggi X “, ha spiegato il primo autore dello studio il Dr. Sreejesh Shanker, uno scienziato senior del laboratorio Prasad.
Per rispondere alla domanda di come gli anticorpi impediscono al norovirus di legarsi a HBGA, Shanker ha purificato il complesso del dominio P norovirus con la parte di anticorpo che si lega al dominio, chiamata frammento Fab, di un anticorpo IgA umano. Ha quindi utilizzato con successo la cristallografia a raggi X per determinare la struttura del complesso.
“Abbiamo scoperto che il frammento Fab si lega in prossimità del sito di legame HBGA. Non cambia la struttura del sito di legame HBGA, ma fisicamente blocca l’accesso al sito”, ha spiegato Shanker.
Questi risultati aprono la possibilità di sviluppare composti che imitano la struttura del frammento Fab e che possono essere utilizzati come agente terapeutico per bloccare l’ingresso del virus nella cellula e quindi combattere l’infezione da norovirus”, ha detto Prasad.
“Abbiamo anche la possibilità di utilizzare questi agenti terapeutici bloccanti nel trattamento delle infezioni da norovirus nei pazienti trapiantati affetti da queste infezioni che possono essere fatali”, ha aggiunto il co-autore senior dello studio, la Dr. Maria Estes, Professor of Human and Molecular Virology and Microbiology al Baylor e Direttore e fondatore del Texas Medical Center Digestive Diseases Center.
Altri collaboratori di questo lavoro sono Rita Czakó, Gopal Sapparapu, Gabriela Alvarado, Maria Viskovska, Banumathi Sankaran, Robert L. Atmar e James E. Crowe Jr. Questi collaboratori sono affiliati della Baylor e / o Vanderbilt University Medical Center.