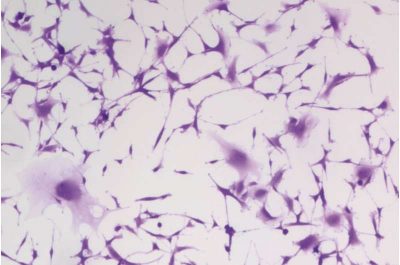
Glioblastoma-immagine:ricercatori del laboratorio Megan Matthews della Penn hanno trattato le cellule tumorali cerebrali di glioblastoma umano con Idralazina, uno dei farmaci più antichi conosciuti per la pressione sanguigna e trattamento di prima linea per la preeclampsia, per tre giorni. Al terzo giorno (immagine), un numero maggiore di cellule si ingrandisce e si appiattisce, un segno distintivo della senescenza, la “modalità di sospensione” che non si divide e che arresta la crescita del tumore. Crediti: Kyosuke Shishikur.
Un team guidato dalla Penn University ha svelato come l’Idralazina, uno dei farmaci più antichi al mondo per la pressione sanguigna e un trattamento fondamentale per la preeclampsia, agisca a livello molecolare. Così facendo, hanno fatto una scoperta sorprendente: può anche arrestare la crescita di tumori cerebrali aggressivi come il glioblastoma.
Negli ultimi 70 anni, l’Idralazina è stata uno strumento indispensabile in medicina, una difesa di prima linea contro l’ipertensione potenzialmente letale, soprattutto durante la gravidanza. Ma nonostante il suo ruolo essenziale, persiste un mistero fondamentale: nessuno ne conosce il “meccanismo d’azione”, ovvero come funziona a livello molecolare, il che ne consente una migliore efficacia, sicurezza e le sue proprietà terapeutiche.
“L’idralazina è uno dei primi vasodilatatori mai sviluppati ed è ancora un trattamento di prima linea per la preeclampsia, un disturbo ipertensivo che rappresenta il 5-15% dei decessi materni in tutto il mondo”, afferma Kyosuke Shishikura, medico-scienziato presso l’Università della Pennsylvania. “È nato da un’era di scoperta di farmaci ‘pre-target’, quando i ricercatori si basavano prima su ciò che osservavano nei pazienti e solo in seguito cercavano di spiegarne la biologia”.
Ora Shishikura, la sua relatrice post-dottorato alla Penn Megan Matthews e i suoi collaboratori hanno risolto questo enigma di vecchia data.
Nel loro articolo pubblicato su Science Advances, il team ha scoperto il meccanismo d’azione dell’Idralazina e, così facendo, ha rivelato un inaspettato legame biologico tra disturbi ipertensivi e cancro al cervello. I risultati evidenziano come trattamenti consolidati possano rivelare un nuovo potenziale terapeutico e potrebbero contribuire alla progettazione di farmaci più sicuri ed efficaci sia per la salute materna che per il cancro al cervello.
“La preeclampsia ha colpito generazioni di donne nella mia famiglia e continua ad avere un impatto sproporzionato sulle madri nere negli Stati Uniti“, afferma Matthews. “Comprendere il funzionamento dell’idralazina a livello molecolare offre un percorso verso trattamenti più sicuri e selettivi per l’ipertensione correlata alla gravidanza, migliorando potenzialmente i risultati per le pazienti a maggior rischio“.
Il team ha scoperto che l’Idralazina blocca un enzima che rileva l’ossigeno chiamato 2-amminoetantiol diossigenasi (ADO), un interruttore molecolare che segnala ai vasi sanguigni quando contrarsi.
“ADO è come un campanello d’allarme che suona nel momento in cui l’ossigeno inizia a diminuire”, afferma Matthews. “La maggior parte dei sistemi del corpo richiede tempo: devono copiare il DNA, produrre RNA e costruire nuove proteine. ADO salta tutto questo. Attiva un interruttore biochimico in pochi secondi“.
L’Idralazina agisce legandosi all’ADO e bloccandolo, il che significa che “silenzia” efficacemente l’allarme dell’ossigeno. Una volta silenziato l’enzima, le proteine di segnalazione che normalmente degrada, chiamate regolatori della segnalazione delle proteine G (RGS), sono rimaste stabili.
“L’accumulo di proteine RGS”, afferma Shishikura, “comunica ai vasi sanguigni di smettere di restringersi, annullando di fatto il segnale di “spremitura” “. Questo riduce i livelli di calcio intracellulare, che lui definisce il “principale regolatore della tensione vascolare”. Quando i livelli di calcio diminuiscono, la muscolatura liscia delle pareti dei vasi sanguigni si rilassa, causando vasodilatazione e un calo della pressione sanguigna.
Dalla preeclampsia al cancro al cervello: un obiettivo comune
“Prima di questo studio, ricercatori e medici oncologi avevano iniziato a sospettare che l’ADO fosse importante nel glioblastoma, dove i tumori spesso devono sopravvivere in sacche con bassissimi livelli di ossigeno”, spiega Shishikura. Livelli elevati di ADO e dei suoi prodotti metabolici erano stati associati a una malattia più aggressiva, suggerendo che inibire questo enzima potesse essere una strategia efficace, ma nessuno aveva un buon inibitore per testare questa idea.
Per verificare se l’Idralazina fosse un candidato, Shishikura ha lavorato a stretto contatto con i biochimici strutturali dell’Università del Texas, che hanno utilizzato la cristallografia a raggi X, una tecnica di imaging ad alta risoluzione, per visualizzare l’Idralazina legata al centro metallico dell’ADO e con i neuroscienziati dell’Università della Florida, che hanno testato gli effetti del farmaco sulle cellule tumorali del cervello.
Hanno scoperto che il pathway ADO che regola la contrazione vascolare aiuta anche le cellule tumorali a sopravvivere in ambienti a basso contenuto di ossigeno. A differenza della chemioterapia, che mira a uccidere tutte le cellule all’istante, l’Idralazina ha interrotto questo ciclo di rilevamento dell’ossigeno, innescando la “senescenza” cellulare, ovvero uno stato dormiente e non in divisione nelle cellule di glioblastoma, bloccando di fatto la crescita senza innescare ulteriore infiammazione o resistenza.
Leggi anche: Glioblastoma: scoperto un nuovo tallone di Achille
Sbloccare il potenziale per altri trattamenti salvavita
I ricercatori affermano che il passo successivo sarà quello di spingere ulteriormente la chimica creando nuovi inibitori dell’ADO più specifici per ogni tessuto e più efficaci nell’attraversare o sfruttare i punti deboli della barriera emato-encefalica, in modo da colpire duramente il tessuto tumorale risparmiando il resto del corpo.
Matthews sta inoltre lavorando per continuare a progettare la prossima generazione di soluzioni mediche, svelando i meccanismi di trattamenti clinicamente testati e noti da tempo.
“È raro che un vecchio farmaco cardiovascolare finisca per insegnarci qualcosa di nuovo sul cervello”, afferma Matthews, “ma è proprio quello che speriamo di scoprire di più: collegamenti insoliti che potrebbero portare a nuove soluzioni”.
Fonte:Science Advances