Sistema immunitario-Immagine: abstract credito Immunity.
Il sistema immunitario si trova a dover trovare un delicato equilibrio: deve essere sufficientemente aggressivo da combattere infezioni e cancro, ma anche sufficientemente moderato da evitare di attaccare i tessuti del corpo stesso.
Più di due decenni fa, i ricercatori hanno identificato un gene chiamato FOXP3 che svolge un ruolo fondamentale nel mantenimento di questo equilibrio e nella prevenzione delle malattie autoimmuni: un lavoro che è valso quest’anno il premio Nobel per la fisiologia o la medicina.
Ora, gli scienziati del Gladstone Institute e dell’Università della California a San Francisco (UCSF) hanno mappato l’intricata rete di interruttori genetici che le cellule immunitarie utilizzano per regolare con precisione i livelli di FOXP3. I loro risultati, pubblicati su Immunity, hanno importanti implicazioni per lo sviluppo di terapie immunitarie e affrontano un mistero di lunga data sul perché questo gene si comporti in modo diverso negli esseri umani rispetto ai topi.
“FOXP3 è assolutamente essenziale per la regolazione del nostro sistema immunitario”, afferma Alex Marson, MD, Ph.D., Direttore del Gladstone-UCSF Institute of Genomic Immunology, che ha guidato lo studio. “Il modo in cui viene controllato è una questione fondamentale dell’immunologia e una risposta dettagliata potrebbe offrire indizi per lo sviluppo di future terapie per le malattie autoimmuni o il cancro“.
Una ricerca di interruttori dimmer
Il gene FOXP3 è attivo in tutti i linfociti T regolatori, che tengono sotto controllo le reazioni immunitarie. Senza questo gene, i linfociti T regolatori non possono funzionare correttamente e il sistema immunitario perde il controllo, attaccando i tessuti dell’organismo. Le persone con mutazioni nel gene FOXP3 sviluppano malattie autoimmuni rare e gravi.
Nei topi, FOXP3 è attivato solo nei linfociti T regolatori. Ma negli esseri umani, anche i linfociti T convenzionali – le cellule infiammatorie che combattono le infezioni – possono attivare brevemente FOXP3. Questa differenza ha lasciato perplessi gli immunologi per anni.
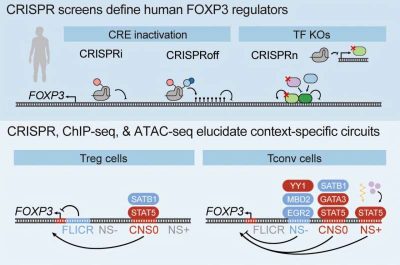
Nel nuovo lavoro, il laboratorio di Marson ha utilizzato la tecnologia di silenziamento genico basata su CRISPR per testare sistematicamente 15.000 siti nel DNA che circonda il gene FOXP3. Stavano cercando elementi regolatori genetici , ovvero tratti di DNA vicini che agiscono come interruttori dimmer, controllando quando e quanto un gene viene attivato o disattivato.
Interrompendo migliaia di posizioni nelle cellule T convenzionali e regolatrici sia umane che murine e misurando poi gli effetti sui livelli di FOXP3, il team ha identificato quali sequenze di DNA vicine controllano FOXP3.
“Abbiamo essenzialmente creato una mappa funzionale dell’intero sistema di controllo FOXP3”, afferma Jenny Umhoefer, Ph.D., ex ricercatrice post-dottorato nel laboratorio di Marson e prima autrice del nuovo articolo.
Pannelli di controllo immunitario
Gli esperimenti hanno rivelato che diversi tipi di cellule umane hanno sistemi di controllo diversi per il gene FOXP3. Nelle cellule T regolatorie, dove FOXP3 deve rimanere costantemente attivo, più enhancer – sequenze di DNA che aumentano i livelli di un gene – lavorano insieme per garantire che il gene rimanga attivo. Poiché agiscono in modo ridondante, l’interruzione di uno solo di questi enhancer ha avuto solo un effetto limitato sui livelli di FOXP3.
Nei linfociti T convenzionali, sono stati mappati solo due enhancer. Ma i ricercatori hanno anche scoperto un repressore inaspettato che agisce come un freno sul gene FOXP3.
“Quello che stiamo osservando è un sofisticato circuito regolatore”, afferma Umhoefer. “La cellula ha pedali dell’acceleratore e freni e li coordina per ottenere un controllo preciso.”
Per comprendere non solo dove si trovino questi interruttori genetici, ma anche cosa li controlli, il team ha condotto un secondo screening CRISPR su larga scala. Questa volta, hanno sistematicamente alterato quasi 1.350 geni in tutto il genoma per identificare proteine specifiche che controllano i livelli di FOXP3.
Successivamente, in collaborazione con il ricercatore affiliato di Gladstone Ansuman Satpathy, MD, Ph.D., il team ha utilizzato una tecnica chiamata ChIP-seq per mappare fisicamente la posizione delle proteine sul DNA in relazione al gene FOXP3.
“Questo ha rappresentato un grande passo avanti nello sviluppo di metodi per collegare gli elementi regolatori locali con le proteine che effettivamente si legano a essi“, afferma Satpathy, che è anche Professore associato presso il Dipartimento di Patologia della Stanford School of Medicine. “Nessuno prima d’ora aveva messo insieme questi strumenti in modo così ampio e sistematico“.
Un mistero di specie
Il laboratorio di Marson aveva inizialmente ipotizzato che negli esseri umani i linfociti T convenzionali potessero avere un enhancer per attivare FOXP3, assente nei topi, il che spiega perché le cellule di topo non attivano mai il gene. Sorprendentemente, hanno scoperto che i linfociti T convenzionali nei topi presentano tutti gli stessi elementi enhancer degli esseri umani.
La differenza, hanno capito gli scienziati, potrebbe risiedere nel repressore da loro scoperto. Nei linfociti T convenzionali del topo, questo repressore mantiene FOXP3 costantemente disattivato. Quando i ricercatori hanno utilizzato CRISPR per eliminare il repressore dal DNA dei topi, i linfociti T convenzionali hanno iniziato a esprimere il gene FOXP3 come le cellule umane.
“È stato un risultato sorprendente”, afferma Marson. “Rimuovendo un singolo elemento repressivo, siamo riusciti a eliminare la differenza di specie e a consentire ai linfociti T convenzionali nei topi di esprimere FOXP3. Questo offre nuovi indizi su come la regolazione dei geni chiave potrebbe evolversi tra le specie“.
I risultati evidenziano l’importanza di studiare la regolazione genica nelle cellule umane e sottolineano la necessità di ricercare i repressori in modo più ampio, non solo gli elementi potenziatori più comuni.
Leggi anche: Sistema immunitario: una prolungata giovinezza immunitaria può essere dannosa per l ospite che invecchia
Ingegneria cellulare di precisione
Il nuovo studio fornisce le basi per gli sforzi continui volti a scoprire e sviluppare nuovi trattamenti per una serie di malattie. Grazie a una mappa completa dei diversi elementi coinvolti nel controllo dei livelli del gene FOXP3, i ricercatori possono iniziare a sviluppare nuovi modi per modificare questi livelli per le immunoterapie.
Ad esempio, i trattamenti per le malattie autoimmuni potrebbero trarre beneficio da livelli più elevati di FOXP3, mentre i trattamenti per il cancro potrebbero funzionare meglio con una minore attività di FOXP3.
“Al momento sono in corso enormi sforzi per curare le cellule T regolatrici, sia per promuoverne l’attività che per ridurla”, afferma Marson. “Man mano che comprendiamo nuovi aspetti del circuito che distingue le cellule T regolatrici dalle cellule convenzionali, possiamo pensare a strategie per manipolarlo razionalmente“.
Fonte: Immunity