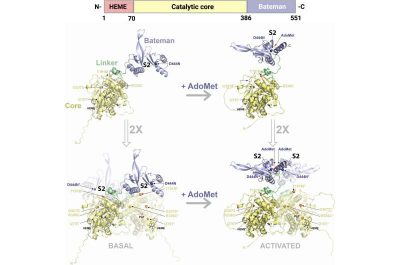
Omocistinuria-Immagine: struttura 3D di HsCBS. (In alto) Rappresentazione schematica dell’organizzazione del dominio HsCBS. Il sito di legame dell’eme è mostrato in rosso, il nucleo catalitico (simile alla famiglia PLP-fold di tipo II) è evidenziato in giallo e il modulo di Bateman è rappresentato in blu. Le molecole di PLP, HEME e AdoMet sono mostrate in barre. Crediti: The FEBS Journal (2025).
Un team di ricerca internazionale ha pubblicato uno studio sulla rivista The FEBS Journal che apporta un significativo avanzamento alla conoscenza di una rara malattia metabolica ereditaria: l’omocistinuria classica. Il team è stato coordinato dai gruppi di Malattie del Fegato e Chimica Computazionale del centro di ricerca CIC bioGUNE, membro del BRTA.
Questo disturbo di origine genetica impedisce la corretta eliminazione dell’omocisteina, un amminoacido che, se presente in concentrazioni elevate, può causare complicazioni in vari organi e sistemi del corpo umano, tra cui il sistema vascolare e nervoso, gli occhi e lo scheletro.
La ricerca si è concentrata su una specifica mutazione, nota come R336C, che colpisce l’ enzima cistationina beta-sintetasi (CBS), essenziale per il metabolismo dell’omocisteina. Lo studio rivela che, contrariamente a quanto si pensava in precedenza, questa variante preserva pressoché intatta la struttura complessiva dell’enzima, ma presenta una flessibilità anomala che ne riduce significativamente la capacità di svolgere la sua funzione biologica. Ciò contribuisce all’accumulo di amminoacidi nell’organismo.
Una delle principali scoperte del team è stata come la mutazione innesca una cascata di sottili cambiamenti strutturali che si propagano su lunghe distanze, dall’ambiente circostante immediato agli amminoacidi vicini al cofattore piridossal fosfato (PLP, un derivato della vitamina B6), essenziale per l’attività enzimatica.
Invece di stabilizzare la sua forma funzionale, l’enzima mutato tende a interrompere la comunicazione tra il cofattore e il sito catalitico, favorendo una conformazione inattiva. Questo spiega la perdita di efficienza catalitica senza alterare la struttura tridimensionale complessiva della proteina.
Inoltre, è stato osservato che questa mutazione influenza la mobilità intrinseca del cosiddetto modulo di Bateman, una regione dell’enzima chiave per la sua regolazione. Sebbene l’enzima mutato possa ancora assemblarsi correttamente, i suoi cambiamenti dinamici tendono a ostacolare l’accesso del substrato alla cavità in cui si suppone che avvenga la reazione chimica che dovrebbe catalizzare.
Lo studio, a cui hanno partecipato anche professionisti della rete di ricerca biomedica CIBERehd, dell’Università del Qatar e dell’Università di Verona, apre le porte a nuove strategie terapeutiche per le persone affette da questa patologia.
Questo studio fornisce una delle poche strutture tridimensionali di un mutante dell’enzima CBS umano finora chiarite. Le informazioni ottenute sono rilevanti perché spiegano le cause della disfunzione catalitica della variante R336C, una delle oltre 200 mutazioni patogene descritte finora.
Leggi anche:Sindrome di Door: nuova terapia potrebbe curare malattie rare ed ereditarie
“Il nostro lavoro offre una spiegazione diversa dalle precedenti proposte che attribuivano la mutazione a un effetto denaturante (perdita di struttura tridimensionale) e all’incapacità dell’enzima mutato di ospitare il cofattore PLP nel suo sito catalitico. I nostri nuovi dati spiegano perché questi pazienti non rispondono bene ai trattamenti basati sull’integrazione di piridossina (vitamina B6) e suggeriscono quali strategie terapeutiche potrebbero essere efficaci nei portatori di questa alterazione genomica. Tra le possibili strategie di intervento identificate vi sono la progettazione di farmaci che ripristinino la comunicazione tra l’enzima e il cofattore PLP e terapie personalizzate volte a ripristinare la dinamica del modulo di Bateman che regola l’accesso del substrato alla cavità catalitica“, spiega il Dott. Luis Alfonso Martínez de la Cruz, ricercatore principale associato del gruppo Malattie del fegato presso CIC bioGUNE.
Questa ricerca sottolinea l’importanza della collaborazione scientifica internazionale e dello studio approfondito delle malattie rare per continuare a progredire verso una medicina più personalizzata ed efficace.
Fonte:The FEBS Journal