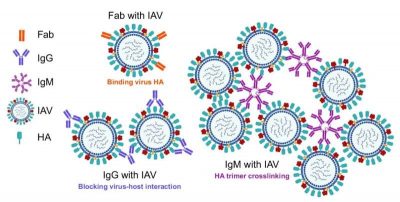
Influenza A-Immagine: meccanismo ipotetico di interazione epitopo-paratopo basato sulla valenza e di reticolazione (creato in BioRender; https://BioRender.com/fvt7dkf). Crediti: Nature Communications (2025)
Un nuovo studio dimostra che gli scienziati hanno progettato un anticorpo monoclonale in grado di proteggere i topi da una dose letale di influenza A. La nuova molecola combina la specificità di un anticorpo anti-influenzale maturo con l’ampia capacità di legame di un anticorpo di difesa più generale del sistema immunitario.
L’effetto protettivo è stato potenziato somministrando l’anticorpo tramite uno spray nasale che disperde queste molecole in tutto il tratto respiratorio, dove si attaccano alla mucosa scivolosa in attesa di particelle virali invasori.
La molecola ingegnerizzata si basa sulla versione IgM di un anticorpo immunoglobulina, la prima linea generica di difesa anticorpale contro le infezioni, ma con una caratteristica strutturale aggiuntiva che si attacca a un punto molto specifico sulla superficie del virus dell’influenza A per neutralizzare il virus.
“È una piattaforma migliore con un anticorpo migliore. Se riusciamo a preparare l’ambiente respiratorio con questa molecola ingegnerizzata e potenziata, possiamo catturare e intercettare il virus in una fase precoce”, ha affermato Kai Xu, coautore principale dello studio e Professore associato di bioscienze veterinarie presso la Ohio State University.
“Questa potrebbe essere una terapia che non solo può essere utilizzata per prevenire l’influenza stagionale, ma potrebbe potenzialmente essere utilizzata anche contro i ceppi pandemici futuri“, aggiunge.
Lo studio è stato pubblicato su Nature Communications.
I virus dell’influenza A sono suddivisi in sottotipi in base alle caratteristiche di due principali proteine di superficie, l’emoagglutinina (HA) e la neuraminidasi (NA), come ad esempio il ceppo che circola annualmente tra le persone, l’H1N1, e il virus H3N2 meno comune che co-circola durante la stagione influenzale.
Studi precedenti hanno dimostrato che gli anticorpi monoclonali IgG progettati per colpire la proteina HA dell’influenza A perdono efficacia man mano che il virus muta per uscire dal loro mirino.
Questi anticorpi, che imitano i sistemi immunitari adattativi naturali e maturi contro l’influenza, si legano a una precisa sezione della proteina di superficie per inibire la capacità del virus di legarsi a un recettore della cellula ospite e di entrare nella cellula per creare copie di se stesso. Ma una volta che i virus capiscono dove vengono presi di mira dagli anticorpi, mutano quei siti per sfuggire al riconoscimento da parte del sistema immunitario.
Xu e colleghi hanno ipotizzato che la creazione di un anticorpo anti-influenzale basato sull’isotipo IgM (un risponditore immunitario precoce di prima linea, noto per la sua forma pentamerica) dotato di più siti strutturali in grado di legarsi alla proteina HA e di un bersaglio stretto e preciso a livello di IgG, aumenterebbe la capacità di neutralizzazione dell’anticorpo.
Il team ha costruito e valutato 18 anticorpi IgM sulla base di anticorpi IgG esistenti noti per colpire diversi segmenti della proteina HA, individuando una versione di IgM che si è dimostrata superiore negli studi sulle colture cellulari nel neutralizzare un pannello di virus influenzali H1N1 e H3N2 che circolano nelle persone da almeno 50 anni.
“Il vantaggio è che abbiamo sfruttato la caratteristica multivalenza delle IgM combinata con la potenza di un anticorpo maturo ad ampia neutralizzazione“, ha affermato Xu. “Multivalente significa che questa molecola ha più bracci per catturare il virus, quindi il virus ha pochissime possibilità di sfuggirgli. E poiché l’IgM è una molecola di grandi dimensioni, quando si lega alla superficie virale, di fatto la ricopre, impedendo così il coinvolgimento del recettore“.
Gli esperimenti hanno dimostrato che, anche se una mutazione influenzasse la forte attrazione di questo anticorpo IgM verso uno specifico sito di legame dell’HA, le grandi dimensioni e la multivalenza dell’anticorpo potrebbero aiutarlo a superare i tentativi di fuga virale.
“Migliorando la sua capacità di riconoscere le regioni superficiali virali mutate o differenziate, può offrire una protezione incrociata contro diverse infezioni da virus influenzali e può funzionare anche dopo che si sono verificate le mutazioni”, ha affermato Xu.
Negli esperimenti sui topi, i ricercatori hanno somministrato una singola dose di anticorpo IgM tramite uno spray nasale, con l’intento di stendere uno strato di anticorpo ingegnerizzato sulle superfici mucose delle cavità nasali e dei polmoni.
“Lo scopo principale è respingere i virus prima che possano entrare in una cellula ospite“, ha affermato Xu. “L’immunità mucosale è più efficiente dell’immunità sistemica nell’intercettarli, quindi l’infezione iniziale può essere ridotta o eliminata“.
Spiegano gli autori:
“La progettazione di anticorpi monoclonali (mAb) ampiamente neutralizzanti, diretti contro l’emoagglutinina (HA) del virus dell’influenza A (IAV), rappresenta un approccio promettente per il trattamento dell’influenza stagionale. Tuttavia, la plasticità dell’HA porta spesso alla formazione di ceppi resistenti che ne compromettono la potenza come IgG bivalenti. In questo articolo ipotizziamo che la multimerizzazione degli anticorpi anti-IAV come IgM possa migliorare la copertura e la potenza neutralizzante. In questo studio, costruiamo 18 anticorpi IgM a partire da IgG ampiamente neutralizzanti note, dirette contro diversi epitopi dell’HA del virus dell’influenza A (IAV) e ne valutiamo l’ampiezza e la potenza neutralizzante contro diversi virus dell’influenza A (IAV) H1N1 e H3N2“.
I ricercatori hanno somministrato insieme allo spray nasale preventivo, dosi letali di virus influenzali H1N1 e H3N2. Rispetto agli animali di controllo non sottoposti a trattamento preventivo, i topi trattati con l’anticorpo IgM hanno avuto risultati migliori: nessun topo si è ammalato a causa del ceppo H3N2 e la maggior parte è sopravvissuta all’infezione da H1N1 e si è ripresa dai sintomi.
Le molecole sono rimaste sulla superficie della mucosa del topo per sette giorni, il che indica che un singolo spruzzo potrebbe durare per settimane negli esseri umani.
“L’adesività della molecola estende la sua finestra di protezione e questo è uno dei vantaggi di questa strategia“, ha affermato Xu.
Leggi anche:Influenza aviaria: esite il rischio di una futura pandemia?
“Sebbene questo lavoro si sia concentrato sulle versioni storiche e stagionali dell’influenza A“, ha affermato Xu, “il team di biologi strutturali, immunologi e virologi considera i risultati come una prova di principio per aiutare a stabilire la piattaforma IgM come potenziale tecnologia terapeutica per diversi virus, tra cui l’influenza aviaria, il virus dell’influenza A H5, e persino malattie non virali come il cancro”.
Fonte: Nature Communications