Virus Hendra-Immagine:Virus Hendra (HeV). Crediti immagine: Corona Borealis Studio / Shutterstock.com
Il cambiamento climatico e la destabilizzazione dell’habitat stanno avvicinando pipistrelli, cavalli ed esseri umani, alimentando la diffusione del virus Hendra. Scopri come un approccio One Health può interrompere la catena di trasmissione e proteggere da future epidemie.
Il virus Hendra (HeV) è un membro del genere Henipavirus, appartenente alla famiglia Paramyxoviridae. L’HeV è stato inizialmente scoperto nel 1994 durante un’epidemia di malattia respiratoria fatale nei cavalli a Hendra, un sobborgo di Brisbane, in Australia. L’epidemia ha coinvolto 21 cavalli, 14 dei quali sono morti o sono stati soppressi, oltre a due infezioni umane, di cui una mortale.
Dalla scoperta dell’HeV, sono state segnalate epidemie sporadiche in tutto il Queensland e il Nuovo Galles del Sud, principalmente a causa della trasmissione da volpi volanti a cavalli e, occasionalmente, da cavalli all’uomo. È stato documentato anche un caso in un cane, evidenziando così il potenziale di trasmissione interspecie dell’HeV.
Virologia e patogenesi
HeV è un virus pleomorfo e dotato di envelope, con una morfologia che va da particelle sferiche a filamenti allungati. Sia la glicoproteina di attacco (G) che la proteina di fusione (F) sporgono dalla membrana virale, consentendo l’ingresso nella cellula ospite attraverso i recettori dell’efrina B2 e B3.
Il genoma dell’acido ribonucleico (RNA) virale a filamento singolo, a senso negativo e non segmentato è legato alle proteine del nucleocapside (N), che formano un complesso ribonucleoproteico (RNP) che antagonizza le risposte immunitarie innate.
Il serbatoio naturale dell’HeV è costituito dalla specie di pipistrelli della frutta Pteropus, altrimenti noti come volpi volanti, oltre alle specie P. alecto, P. poliocephalus, P. scapulatus e P. conspicillatus che ospitano anch’esse l’HeV. 6 Il contagio virale ai cavalli avviene in genere quando gli animali ingeriscono o inalano cibo o acqua contaminati da escrementi o urina di pipistrello.
L’infezione umana avviene attraverso il contatto ravvicinato con cavalli infetti e con i loro fluidi corporei, come sangue, secrezioni nasali e saliva. Ad oggi, non si è verificata alcuna trasmissione da uomo a uomo.
Sebbene rara, la malattia umana è spesso grave e si presenta con sintomi simil-influenzali che possono progredire fino all’encefalite o all’insufficienza respiratoria. Con un tasso di mortalità del 57% e senza trattamenti approvati, l’HeV rimane un patogeno zoonotico ad alta priorità che richiede misure di biosicurezza di livello 4 (BSL4).
Fattori ecologici dell’emergenza
L’emergenza di HeV è associata a sconvolgimenti ecologici, in particolare alla perdita di habitat e ai cambiamenti climatici. L’esteso disboscamento per l’agricoltura, l’attività mineraria e lo sviluppo urbano ha frammentato gli habitat naturali, spostando così le volpi volanti e aumentando la loro vicinanza alle popolazioni umane ed equine.
La siccità, la scarsità di cibo e lo stress dovuto alle temperature estreme interrompono i modelli di foraggiamento, migrazione e appollaiarsi dei pipistrelli. Questo spostamento costringe le volpi volanti a rifugiarsi in frutteti, recinti e cortili, dove i cavalli possono ingerire escrementi contaminati.
Il cambiamento climatico sta peggiorando le zone ad alto rischio di spillover per l’HeV, spostando gli areali dei pipistrelli, alterando i modelli di fioritura e intensificando la siccità. La scarsa fioritura degli eucalipti e la perdita dell’habitat costringono le volpi volanti a spostarsi nelle aree urbane, aumentando ulteriormente lo stress e la diffusione del virus .
Ognuno di questi fattori aumenta il rischio di eventi di spillover, in particolare durante la stagione del parto tra agosto e dicembre, che coincide con la stagione invernale nell’Australia orientale. Lo spostamento verso sud di Pteropus alecto in regioni ad alta densità di cavalli, come l’Upper Hunter del Nuovo Galles del Sud, evidenzia come i cambiamenti ecologici causati dal clima stiano intensificando le minacce zoonotiche.
Sorveglianza e rilevamento
Un’efficace sorveglianza e la diagnosi precoce dell’HeV possono prevenire gli eventi di spillover, proteggendo così la salute umana e animale. Il test di reazione a catena della polimerasi con trascrizione inversa quantitativa (qRT-PCR) può essere utilizzato per misurare i livelli di antigene HeV in campioni di sangue o tamponi ottenuti da cavalli entro quattro ore.
Anche l’isolamento del virus da tamponi nasofaringei o orofaringei, così come da campioni di sangue coagulato, può confermare la presenza di HeV. Anche i test immunoenzimatici (ELISA) possono essere utilizzati per rilevare anticorpi anti-HeV nel sangue coagulato, fornendo prove di esposizione o infezione pregresse e agevolando il monitoraggio epidemiologico. Inoltre, la sorveglianza sierologica su pipistrelli e cavalli consente ai ricercatori di identificare le aree ad alto rischio per orientare le strategie di vaccinazione e biosicurezza.
Infezioni subcliniche e intermittenti nei pipistrelli, così come sintomi aspecifici o improvvisi nei cavalli, complicano la diagnosi e impediscono l’individuazione precoce dell’HeV. Anche una sorveglianza limitata dei pipistrelli, in particolare di specie chiave come Pteropus Alecto e un accesso diagnostico inadeguato nelle aree rurali possono portare a una significativa sottostima dei casi.
 Credito immagine: CHANUN.V / Shutterstock.com
Credito immagine: CHANUN.V / Shutterstock.com
Strategie di prevenzione e controllo
Interventi veterinari
Il vaccino Equivac® HeV a subunità , costituito da una glicoproteina G solubile, è stato inizialmente sviluppato nel 2012 per prevenire la trasmissione del virus HeV nei cavalli. Questo schema vaccinale prevede due dosi iniziali, una terza dose somministrata sei mesi dopo e richiami annuali. Inducendo la produzione di anticorpi protettivi, il vaccino Equivac® protegge i cavalli dall’infezione fatale, interferendo contemporaneamente con la catena di trasmissione pipistrello-cavallo-uomo. 11
Tuttavia, la diffusione del vaccino rimane bassa a causa della sfiducia nelle aziende farmaceutiche, delle preoccupazioni relative ai costi, della percezione di un basso rischio e della scarsa consapevolezza. Le incomprensioni su sicurezza ed efficacia ne scoraggiano ulteriormente l’uso. Affrontare questi ostacoli attraverso una comunicazione trasparente, incentivi e una sensibilizzazione condotta da veterinari potrebbe migliorare la copertura vaccinale, proteggendo al contempo la salute animale e umana nelle regioni ad alto rischio.
Mitigazione del rischio umano
La mitigazione del rischio umano per l’HeV dipende dall’uso rigoroso di dispositivi di protezione individuale (DPI) durante la cura degli equini e l’autopsia, poiché i cavalli infetti possono diffondere il virus anche prima della comparsa dei sintomi. Un DPI completo, che includa guanti, respiratori o mascherine, camici, visiere e calzature protettive, è essenziale per proteggere veterinari e operatori dall’esposizione.
Fondamentale è anche la formazione continua in materia di salute pubblica per veterinari e proprietari di cavalli. Tra gli sforzi principali rientrano il riconoscimento precoce dei sintomi, la promozione della vaccinazione, l’implementazione di misure di biosicurezza di base e la garanzia del corretto utilizzo dei DPI attraverso una formazione regolare. Una comunicazione aperta promuove la fiducia e incoraggia la tempestività delle segnalazioni, riducendo il rischio di contagio.
Interventi ecologici
Prevenire la diffusione del virus HeV richiede interventi ecologici che riducano il contatto tra volpi volanti e animali domestici. Preservare e ripristinare gli habitat nativi dei pipistrelli, come il ripiantumazione di alberi da frutto e da fiore lontano dalle fattorie, può distogliere i pipistrelli dalla ricerca di cibo vicino ai cavalli, riducendo così il rischio di diffusione del virus nei recinti.
Anche l’istituzione di zone cuscinetto tra i rifugi dei pipistrelli e le aree destinate ai cavalli, ad esempio recintando, spostando i cavalli durante i periodi di massima attività dei pipistrelli e posizionando cibo e acqua lontano dagli alberi frequentati dai pipistrelli, può essere efficace. Queste misure, combinate con pratiche di biosicurezza a livello aziendale, sono fondamentali nelle regioni ad alto rischio per ridurre al minimo il rischio di sversamento.
Implicazioni zoonotiche più ampie
HeV e il virus Nipah (NiV) sono membri strettamente correlati del genere Henipavirus , responsabili di gravi epidemie zoonotiche. Mentre l’HeV colpisce principalmente cavalli ed esseri umani in Australia, il NiV ha causato infezioni umane fatali nel Sud-est asiatico, con tassi di mortalità che hanno raggiunto il 100% in alcune epidemie.
Le somiglianze genetiche tra HeV e NiV, unite all’ampia gamma di ospiti, sollevano preoccupazioni circa l’evoluzione o la ricombinazione virale. Ciò è particolarmente preoccupante in un contesto di perdita di habitat, cambiamenti climatici e aumento dei contatti tra specie, che creano condizioni ideali per l’adattamento e la potenziale trasmissione da uomo a uomo.
Questi rischi sottolineano l’importanza di un approccio One Health, che tenga conto dell’interconnessione tra la salute animale, umana e ambientale attraverso una sorveglianza coordinata, la protezione ecologica, la vaccinazione e l’educazione, per prevenire futuri effetti collaterali .
Lacune nella ricerca e direzioni future
I modelli di previsione dello spillover devono incorporare dati climatici, ecologia dei pipistrelli, temperatura, copertura forestale del paesaggio, cambiamenti nell’uso del suolo, densità della popolazione umana e pratiche di gestione equina. Sebbene sia disponibile un vaccino equino autorizzato, non esiste un vaccino umano o una terapia antivirale approvati. Candidati promettenti, come un vaccino umano a subunità e l’anticorpo monoclonale m102.4, sono ancora in fase di valutazione per la loro sicurezza, efficacia e protezione a lungo termine come trattamenti post-esposizione.
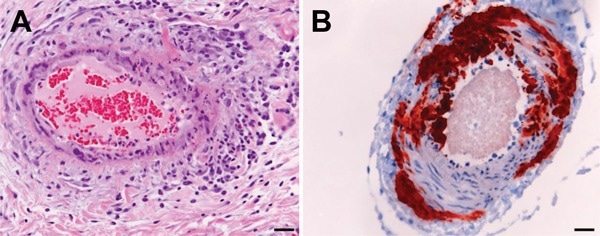
Risultati istologici e immunoistologici in tessuto equino infetto dal virus Hendra. A) La colorazione con ematossilina ed eosina mostra una vasculite sistemica a carico del polmone. B) L’esame immunoistologico, utilizzando una proteina policlonale di coniglio anti-Nipah, indica la presenza dell’antigene del virus Hendra in un vaso sanguigno cerebrale. Le barre della scala rappresentano 50 μm.
Sono inoltre necessarie ricerche longitudinali per chiarire come il cambiamento climatico, lo stress nutrizionale, i cicli riproduttivi dei pipistrelli e la frammentazione dell’habitat influenzino la diffusione e la trasmissione del virus. Queste informazioni possono essere utilizzate per perfezionare le strategie di previsione e prevenzione delle epidemie.
La collaborazione internazionale è essenziale per mitigare le epidemie di HeV, data la distribuzione globale dei pipistrelli e il loro ruolo nell’insorgenza di zoonosi virali. Il rafforzamento della sorveglianza transfrontaliera, la condivisione dei dati e la ricerca coordinata su diagnosi, vaccini e trattamenti miglioreranno la preparazione globale contro l’HeV e altri patogeni trasmessi dai pipistrelli.
Leggi anche:Langya, il nuovo virus scoperto in Cina
Conclusioni
Prevenire future epidemie di HeV richiede un’azione proattiva e transdisciplinare. Gli sforzi di sorveglianza devono includere il monitoraggio ecologico delle specie serbatoio per consentire un allarme precoce. La protezione e il ripristino degli habitat dei pipistrelli possono ridurre ulteriormente l’interfaccia uomo-animale e affrontare le cause profonde dello spillover.
Un approccio One Health, che combina veterinaria, ecologia, climatologia, sanità pubblica e scienze sociali, è essenziale per sviluppare e attuare strategie di prevenzione efficaci. Integrare la tutela ambientale con una sorveglianza mirata e una collaborazione intersettoriale può contribuire a rafforzare la resilienza contro l’HeV e altre minacce zoonotiche emergenti causate dai cambiamenti ambientali globali.
Fonte:NewsMedical