Ipertensione-Immagine: Abstract grafico. Fonte: Journal of Clinical Investigation (2025).
Quando una persona soffre di pressione alta, o ipertensione, si verificano alterazioni nelle pareti dei vasi sanguigni. Questo processo è noto come rimodellamento arterioso o vascolare, ed è guidato dalle cellule muscolari lisce presenti nella parete dei vasi sanguigni. I ricercatori della Michigan Medicine hanno scoperto un meccanismo chiave che regola la pressione sanguigna e il rimodellamento vascolare – aumentando il rischio a valle di infarto e ictus – nelle persone con una variante genetica legata all’ipertensione, come suggerisce uno studio condotto sia su animali che su campioni umani.
I risultati sono pubblicati sul Journal of Clinical Investigation.
“Questi risultati ampliano la nostra comprensione delle interazioni gene-malattia in un elenco crescente di varianti collegate a diverse condizioni cardiovascolari, come l’ipertensione”, ha affermato Kevin Mangum, MD, Ph.D., primo autore e specializzando in chirurgia vascolare integrata presso l’University of Michigan Health.
Nello studio, i ricercatori hanno analizzato la proteina 3 contenente il dominio Jumonji, comunemente nota come JMJD3, un enzima che è collegato alle variazioni della pressione sanguigna sistolica in ampi studi di associazione che interessano il genoma.
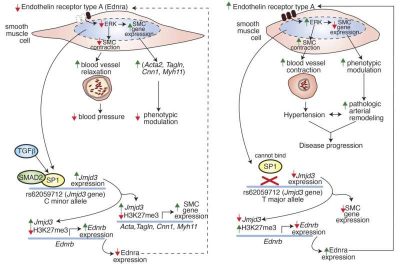
Il team di ricerca ha scoperto che JMJD3 regola l’espressione dei recettori dell’endotelina sulle cellule muscolari lisce.
L‘endotelina, una catena di amminoacidi prodotta dalle cellule endoteliali e da altri tipi di cellule, può legarsi a questi recettori sulle cellule muscolari lisce per controllare il grado di restringimento e dilatazione.
Per studiare il ruolo di JMJD3 nell’ipertensione, i ricercatori hanno ridotto i livelli di JMJD3 nelle cellule muscolari lisce dei topi.
Il team ha scoperto che l’assenza di JMJD3 riduceva la produzione del recettore dell’endotelina B, aumentando al contempo i livelli del recettore dell’endotelina A, il che limitava la dilatazione dei vasi e aumentava la pressione sanguigna.

“Abbiamo visto che JMJD3 è la chiave per un complesso equilibrio tra i due recettori dell’endotelina che regolano la pressione sanguigna“, ha affermato Mangum.
Nel tempo, la ridotta produzione del recettore dell’endotelina B ha rimodellato i vasi sanguigni e aumentato il rischio di complicazioni legate all’ipertensione, come l’aterosclerosi e l’eventuale infarto o ictus, a causa dell’aumento della segnalazione mediata dal recettore dell’endotelina A.
“La carenza di JMJD3 provoca un aumento della pressione sanguigna sistolica, mediato dall’aumento della contrattilità delle cellule muscolari lisce dipendenti dall’endotelina”, ha affermato.
“Ciò avviene nel breve termine, ma il rimodellamento arterioso a lungo termine tipico dell’ipertensione provoca effetti avversi a valle su più sistemi di organi.”
I ricercatori hanno poi preso di mira la variante genetica dell’allele T maggiore rs62059712 , presente in circa il 90% delle persone e associata all’aumento della pressione sanguigna.
Sia nei campioni arteriosi di topi che in quelli umani, hanno scoperto che la variante genetica dell’allele principale diminuisce l’espressione di JMJD3, con conseguente aumento “a doppio colpo” sia della pressione sanguigna che del rimodellamento arterioso.
La variante aumenta l’espressione del recettore dell’endotelina A, che provoca un’ulteriore costrizione dei vasi, e innesca il rimodellamento a valle dei vasi sanguigni attraverso un aumento della segnalazione dell’endotelina-ERK nelle cellule muscolari lisce all’interno della parete arteriosa.
Quando il team di ricerca ha trattato i topi con un composto, il BQ-123, che blocca il recettore dell’endotelina A, l’ipertensione si è invertita dopo l’eliminazione di JMJD3.
Ciò offre potenzialmente una terapia mirata per le persone con la variante genetica rs62059712 per ridurre e gestire l’ipertensione causata dalla segnalazione iperattiva dell’endotelina.
Leggi anche: Ipertensione resistente: scoperta una nuova promettente terapia
“Per questa specifica popolazione, l’introduzione di una terapia personalizzata per regolare la plasticità delle cellule muscolari lisce potrebbe sostanzialmente compensare lo svantaggio genetico che li predispone all’ipertensione“, ha affermato l’autrice principale, Katherine Gallagher, MD,Prof.ssa di chirurgia, microbiologia e immunologia presso la facoltà di medicina dell’UM e vicePresidente della scienza di base e traslazionale presso il Dipartimento di chirurgia dell’UM Health.
Spiegano glii autori:
“L’ipertensione di lunga durata (HTN) colpisce diversi organi e porta a un rimodellamento arterioso patologico, guidato dalla plasticità delle cellule muscolari lisce (SMC). Per identificare i geni rilevanti che regolano la funzione delle SMC nell’ipertensione, abbiamo considerato studi di associazione genomica (GWAS) sulla pressione sanguigna, concentrandoci sui geni che codificano per enzimi epigenetici, che controllano il destino delle SMC nelle malattie cardiovascolari. Utilizzando la mappatura statistica fine del locus della proteina D3 contenente il dominio Jumonji KDM6 ( JMJD3 ), abbiamo scoperto che rs62059712 è la variante casuale più probabile, con ciascuna copia dell’allele T principale associata a un aumento di 0,47 mmHg della pressione arteriosa sistolica. Dimostriamo che l’allele T ha ridotto la trascrizione di JMJD3 nelle SMC attraverso una riduzione del legame di SP1 al promotore di JMJD3. Utilizzando il nostro esclusivo modello murino con deficit di Jmjd3 specifico per le cellule staminali ( Jmjd3 fl/fl Myh11 CreERT ), dimostriamo che la perdita di Jmjd3 nelle cellule staminali (SMC) determina ipertensione arteriosa (HTN) a causa della ridotta espressione del recettore dell’endotelina B ( EDNRB ) e dell’aumentata espressione del recettore dell’endotelina A ( EDNRA ). È importante notare che l’antagonista di EDNRA, BQ-123, ha invertito l’ipertensione arteriosa dopo la delezione di Jmjd3 in vivo. Inoltre, l’RNA-Seq a singola cellula (scRNA-Seq) di arterie umane ha rivelato una forte correlazione tra JMJD3 ed EDNRB nelle SMC. Inoltre, JMJD3 è necessario per l’espressione genica specifica per le SMC e la perdita di JMJD3 nelle SMC ha aumentato il rimodellamento arterioso indotto da ipertensione arteriosa. I nostri risultati collegano una variante del DNA umano associata a ipertensione arteriosa con la regolazione della plasticità delle SMC, rivelando target che potrebbero essere utilizzati nella gestione personalizzata dell’ipertensione arteriosa“.
“La strategia che abbiamo utilizzato per determinare il ruolo di JMJD3 è applicabile a un elenco crescente di varianti genetiche legate a patologie cardiovascolari. Con così tante varianti genetiche note, in futuro l’attenzione dovrebbe essere rivolta ad applicazioni che semplifichino questo processo“.