(SARS-CoV-2-Immagine Credit Public Domain).
Poiché la pandemia SARS-CoV-2 continua a diffondersi a livello globale, gli scienziati stanno ancora imparando a conoscere le sue caratteristiche biologiche virali essenziali. Cosa accade subito dopo l’inalazione di SARS-CoV-2? Dove inizia l’infezione? Quali sono le caratteristiche della successiva diffusione del virus? In che modo le risposte dell’host potrebbero contenere rapidamente l’infezione? Due manoscritti pubblicati di recente hanno valutato l’infezione in colture primarie di cellule ben differenziate per rispondere a queste domande e portare più luce sui componenti provirali e antivirali che operano durante i primi giorni dopo l’esposizione a SARS-CoV-2.
Queste domande fondamentali possono aiutare a comprendere meglio gli effetti di SARS-CoV-2 non appena entra nel corpo poichè ciò che emerge subito dopo l’inalazione del virus rimane ancora poco chiaro.
Nonostante le sfide, le risposte sono arrivate a un ritmo notevole. Saggi sensibili che hanno rilevato l’RNA virale e la proteina in campioni di pazienti COVID 19 hanno rivelato infezioni seno-nasofaringee, delle vie aeree e delle cellule alveolari. I modelli animali hanno rivelato l’accumulo e la distribuzione di SARS-CoV-2 in tutto il sistema polmonare. Le colture aria-liquido dell’interfaccia (ALI) di cellule epiteliali nasali, delle vie aeree e alveolari umane hanno fornito riflessioni trattabili ex vivo del complesso sistema respiratorio umano, adatte per valutare l’infezione nelle cellule respiratorie di diverse regioni anatomiche. Dalle infezioni ex vivo di colture di ALI, sono stati identificati gradienti di suscettibilità al virus, più alti nelle colture derivate dalle cavità nasali e più bassi in quelle dal tratto respiratorio distale. Questi e molti altri risultati fondamentali hanno contribuito a inquadrare la comprensione della trasmissione del virus, della dinamica dell’ingresso e della diffusione del virus nei sistemi respiratori e della conseguente COVID 19 in fase avanzata. Ora, Ravindra e colleghi e Fiege e colleghi hanno esteso questa ricerca, concentrandosi con alta risoluzione sui primi stadi dell’infezione da SARS-CoV-2 e sulle risposte immunitarie innate che si verificano subito dopo. Una nuova ricerca, pubblicata su PLOS Biology, ha valutato l’infezione da SARS-CoV-2 in colture primarie di cellule ben differenziate per determinare come il virus colpisce il corpo e come inizia l’infezione.
Ingresso virale
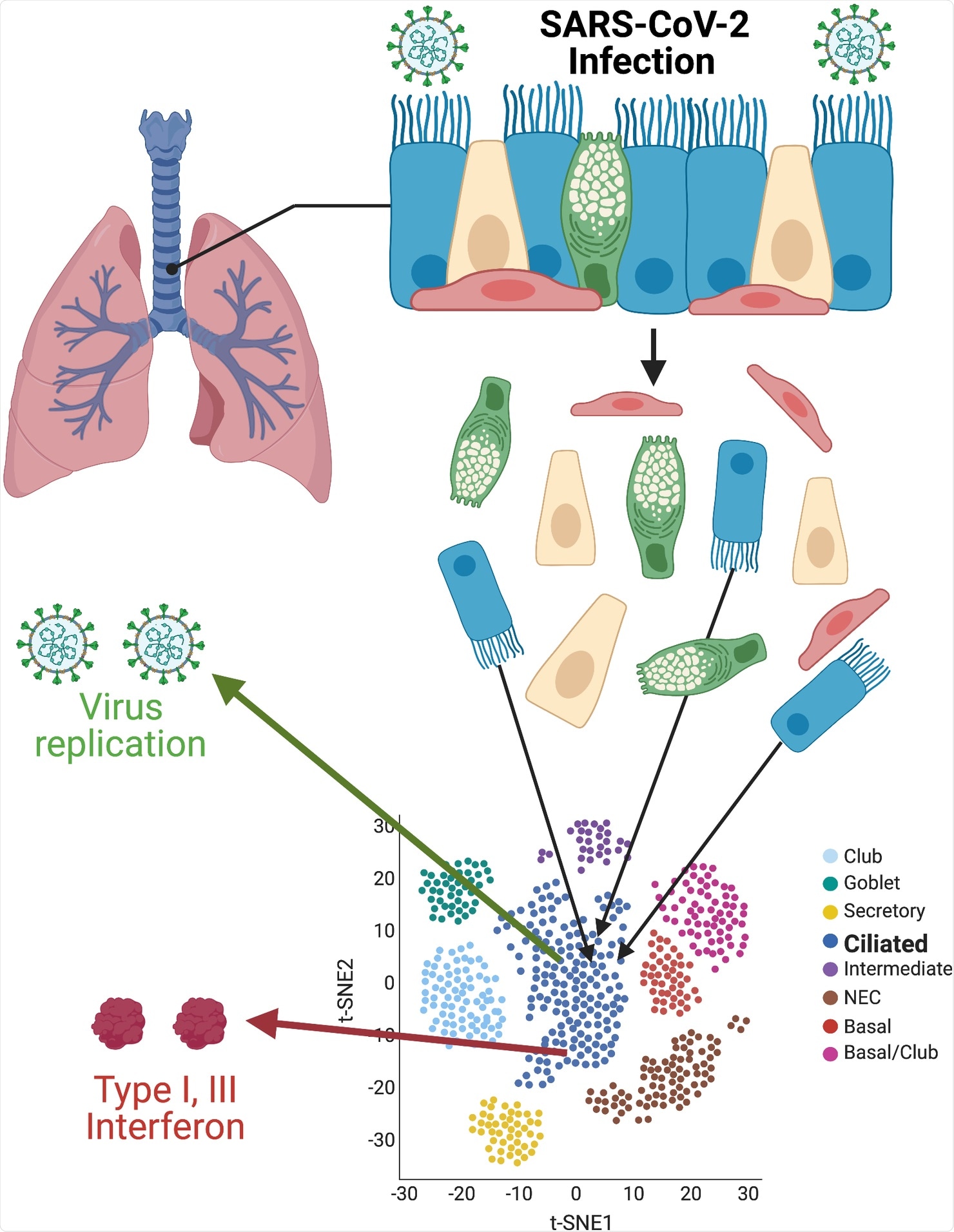
SAR-CoV-2 si lega al recettore dell’enzima di conversione dell’angiotensina 2 (ACE2) umano sulla superficie delle cellule che rivestono il tratto respiratorio. Il virus quindi viaggia attraverso il tratto, un sistema complesso, che comprende passaggi nasali, vie aeree grandi e piccole, bronchioli e alveoli, dove avviene lo scambio di gas. Le complesse relazioni tra l’infezione iniziale e le successive risposte antivirali coordinate si verificano nell’epitelio respiratorio, determinando gli esiti clinici. I test sensibili che rilevano l’RNA virale e la proteina in campioni di pazienti COVID-19 hanno mostrato un’infezione delle cellule seno-nasofaringee, delle vie aeree e delle cellule alveolari. Negli studi sugli animali, i ricercatori hanno determinato l’accumulo e la distribuzione di SARS-CoV-2 nel sistema respiratorio.
Le colture di cellule epiteliali nasali, delle vie aeree e alveolari umane hanno fatto luce sulla complessità del sistema respiratorio. Lo studio di queste cellule può aiutare a determinare come il virus si diffonde nel corpo e i meccanismi utilizzati per la sua diffusione.
Vedi anche:Tripla mutazione in SARS-CoV-2 in India
Infezione precoce da SARS-CoV-2
I ricercatori statunitensi – presso la Loyola University di Chicago e l’Università della Iowa – hanno esteso questa ricerca, ma si sono concentrati sulle immagini ad alta risoluzione dei primi stadi dell’infezione da SARS-CoV-2 e sulle risposte immunitarie innate che ne sono seguite.
Il team ha utilizzato l’infezione di colture di interfaccia aria-liquido (ALI) di derivazione epiteliale bronchiale umana e il sequenziamento dell’RNA a cellula singola per arrivare ai risultati dello studio. Il team di ricerca si è concentrato sul tropismo virale e ha convalidato precedenti rapporti secondo cui l’infezione è inizialmente localizzata nelle cellule ciliate. Le ciglia mobili si trovano nei polmoni, nel tratto respiratorio e nell’orecchio medio. Le cellule ciliate eseguono un movimento ondeggiante o battente per mantenere le vie aeree libere da muco, sporco o agenti patogeni, consentendo una facile respirazione. Il movimento ciliare alterato nel tratto respiratorio può impedire l’eliminazione di agenti patogeni nocivi e corpi estranei inalati. Inoltre, i ricercatori hanno scoperto che una delle proteasi che attivano il virus, la proteasi transmembrana serina 2 (TMPRSS2), era altamente espressa nelle cellule ciliate. Quindi, nel sistema ALI, TMPRSS2, è centrale per il tropismo in quanto recettori ACE2 primari.
Quando l’infezione progredisce, il virus può diffondersi anche ad altre cellule, comprese le cellule basali che sono precursori cruciali per tutti i tipi di cellule epiteliali di superficie. Queste cellule hanno capacità rigenerativa che può essere influenzata dall’infezione da SARS-CoV-2.
Interferone e citochine
I ricercatori hanno anche esplorato le relazioni tra l’accumulo di SARS-CoV-2 RNA e la trascrizione dell’interferone antivirale. La risoluzione della singola cellula ha mostrato che solo una piccola parte delle cellule ciliate fortemente infettate esprimeva interferoni. Tuttavia, queste cellule hanno prodotto abbastanza interferoni di tipo I e III, stimolando un’espressione pan-ALI di geni stimolati da interferone (ISG). Supponiamo che all’inizio dell’infezione sia presente una quantità sufficiente di interferoni. In tal caso, può aiutare a ridurre la malattia nei modelli animali sia di SARS-CoV-2 che del coronavirus della sindrome respiratoria acuta grave da betacoronavirus strettamente correlato (SARS-CoV). Oltre agli interferoni, durante COVID-19, le cellule delle vie aeree rilasciano chemochine come CXCL10 e citochine come l’interleuchina (IL) -6 e IL-8 che innescano il reclutamento di cellule immunitarie adattive e l’infiammazione.
Tuttavia, alcune persone sviluppano una risposta iperinfiammatoria, che è una caratteristica clinica della COVID 19 grave.
Terapie per COVID 19
Gli studi hanno notato che le terapie antivirali dovrebbero arginare l’infiammazione iperattiva preservando gli effettori antivirali stimolati dall’interferone. Hanno aggiunto che tale manipolazione è possibile poiché le colture di ALI infette esposte all’inibitore della replicazione dell’RNA di SARS-CoV-2, Remdesevir, esprimevano ISG, ma non IL-6. “Questi risultati richiamano l’attenzione sul dosaggio e sui regimi temporali dei farmaci antivirali ad azione diretta in modo che le infezioni vengano soppresse preservando risposte immunitarie controllate e appropriate”, hanno spiegato i ricercatori.
Gli studi dimostrano l’utilità dei modelli di infezione ex vivo nell’esplorare gli effetti di SARS-CoV-2 nel corpo, che ha ora infettato oltre 152,88 milioni di persone e ucciso più di 3,20 milioni di persone.
Inoltre, questi studi mostrano come il virus entra e infetta il corpo nelle prime fasi di esposizione.
Fonte:PLOS