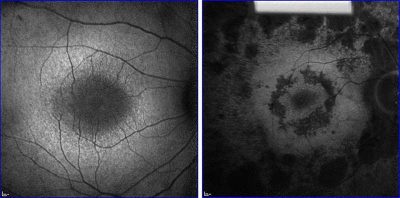
Retinite pigmentosa-Immagine:diversi stadi di degenerazione della retina in due persone con retinite pigmentosa. Credito: foto fornite da Stephen Tsang.
La terapia genica potrebbe essere la migliore speranza per curare la retinite pigmentosa (RP), una condizione ereditaria che di solito porta a una grave perdita della vista e rende ciechi 1,5 milioni di persone in tutto il mondo.
Ma c’è un grosso ostacolo: la retinite pigmentosa può essere causata da mutazioni in oltre 80 geni diversi. Per trattare la maggior parte dei pazienti con RP con la terapia genica, i ricercatori dovrebbero creare una terapia per ciascun gene, un compito quasi impraticabile utilizzando le attuali strategie di terapia genica.
Potrebbe essere imminente un trattamento universale. Utilizzando l’ingegneria genomica basata su CRISPR, gli scienziati del Vagelos College of Physicians and Surgeons della Columbia University stanno progettando una terapia genica con il potenziale per trattare i pazienti con RP indipendentemente dal difetto genetico sottostante.
La terapia sperimentale – che è ancora lontana diversi anni dalla sperimentazione sugli esseri umani – corregge un errore metabolico dell’occhio, nelle cellule sensibili alla luce, che è comune alla maggior parte delle forme della malattia.
In uno studio pubblicato su Cell Reports Medicine, gli ingegneri riferiscono che la loro terapia genica basata su CRISPR può ritardare la progressione della RP per circa un mese nei modelli murini della malattia, equivalente a circa 10 anni negli esseri umani.
I modelli includevano due tipi geneticamente distinti di retinite pigmentosa, suggerendo che la terapia avrebbe funzionato per molte forme del disturbo. Al contrario, l’unica terapia genica RP approvata dalla FDA è adatta solo per poche centinaia di pazienti negli Stati Uniti la cui condizione è causata dal gene che codifica per l’isomerasi RPE65.
“Un ringiovanimento universale e preciso del metaboloma rappresenterebbe un notevole miglioramento rispetto alle limitate opzioni ora disponibili per la maggior parte dei pazienti con RP, che fanno ben poco per prevenire la cecità“, afferma il leader dello studio Stephen Tsang, MD, Ph.D., Professore di oftalmologia e patologia e biologia cellulare.
La sfida clinica
Negli ultimi anni, i ricercatori hanno ipotizzato che, sebbene ciascuno dei quasi 80 geni RP dia origine alla malattia in modo diverso, la perdita della vista di solito si verifica perché i bastoncelli (i fotorecettori responsabili della visione notturna) vengono progressivamente privati di energia.
I bastoncelli ottengono energia scomponendo il glucosio per generare ATP attraverso un processo chiamato glicolisi. Una diminuzione della produzione di energia ATP attraverso la glicolisi è stata osservata sia nei bastoncini malati che in quelli invecchiati.
“La graduale perdita dei bastoncelli provoca disturbi della visione notturna e perdita della visione periferica“, afferma Nicholas Nolan, il primo autore dello studio e dottorando in ingegneria biomedica nel laboratorio di Tsang.
Ma poiché la fornitura di energia dei bastoncelli è collegata alla fornitura di energia di altre cellule della retina, “una volta che i bastoncelli iniziano a morire di fame e a degenerare, ciò provoca un’ondata di fame e degenerazione dei coni, i fotorecettori responsabili della visione dei colori diurna e dell’acuità visiva“, dice Nolan. “Per i pazienti, ciò corrisponde a una devastante perdita della vista diurna“.
In molti casi, la retinite pigmentosa porta alla perdita totale della vista.
La glicolisi potenziata ringiovanisce i neuroni fotorecettori
Nolan e Tsang hanno proposto che il ringiovanimento del metaboloma glicolitico specificamente all’interno dei bastoncelli potrebbe prevenire la degenerazione sia dei bastoncelli che dei coni, rallentare l’invecchiamento della retina e preservare la vista. Sebbene i farmaci orali come il Daprodustat, che migliora la glicolisi, abbiano ricevuto l’approvazione della FDA, hanno un impatto sull’intero corpo e possono causare effetti collaterali indesiderati.
“La nostra soluzione è utilizzare la terapia genica basata su CRISPR per ringiovanire con precisione il metaboloma glicolitico nei bastoncelli“, spiega Nolan.
La terapia sperimentale di Nolan e Tsang è progettata per utilizzare la terapia genica CRISPR per modificare un gene chiamato PHD, innescando così una cascata di cambiamenti che alla fine ringiovaniscono la glicolisi dei bastoncelli.
Per creare la nuova riprogrammazione di precisione, i ricercatori hanno confezionato i componenti del sistema di editing CRISPR in vettori virali adeno-associati che, una volta iniettati nella retina, esprimevano il loro carico genetico solo nei bastoncelli.
“Grazie alle interconnessioni energetiche tra i bastoncelli e il resto della retina, “aumentando la glicolisi dei bastoncelli, ci assicuriamo che i bastoncelli ricevano abbastanza energia, ma manteniamo anche nutrite le loro strutture di supporto. Nel complesso, questo aumenta la resilienza sia bastoncelli che coni“, dice Nolan.
Prossimi passi
Il prossimo passo per la terapia genica proposta è quello di convalidare il meccanismo d’azione con i modelli di degenerazione dei roditori consolidati in laboratorio prima di tradurre questi studi in un modello animale più grande con una struttura dell’occhio che assomigli più da vicino a quella di un essere umano.
Leggi anche:Retinite pigmentosa: ALG6 agisce come un gene modificatore
Spiegano gli autori:
“La retinite pigmentosa (RP) è una delle forme più comuni di neurodegenerazione ereditaria. È causata da una o più delle almeno 3.100 mutazioni in oltre 80 geni espressi principalmente nei bastoncini fotorecettori. Nella RP, la fase primaria di morte dei bastoncelli è seguita dalla morte dei coni, indipendentemente dalla mutazione genetica sottostante che ha causato la degenerazione iniziale dei bastoncelli. Smorzare l’ossidazione dei prodotti finali glicolitici nei mitocondri dei bastoncelli migliora la sopravvivenza dei coni in modelli di malattie eziologiche divergenti, indipendenti dalle mutazioni genetiche sottostanti specifiche dei bastoncelli. L’editing terapeutico del gene della proteina contenente il dominio della prolil idrossilasi (PHD2 , noto anche come Egln1) nei fotorecettori dei bastoncelli ha portato alla sopravvivenza sostenuta sia dei bastoncelli che dei coni malati, sia nei modelli preclinici autosomici recessivi che in quelli dominanti RP. La riprogrammazione terapeutica basata su CRISPR mediata da virus adeno-associati del nodo della glicolisi aerobica può servire come trattamento gene-agnostico per i pazienti con varie forme di RP”.
Astratto grafico

Astratto Grafico-Immagine Credito Cell Reports Medicine-
“Questi studi forniranno una comprensione più chiara del potenziale della terapia di ringiovanimento di precisione e consentiranno di condurre una valutazione della sicurezza più completa. Speriamo di estendere ulteriormente i benefici della nostra terapia genica man mano che impariamo di più sul ringiovanimento del metaboloma glicolitico e su come è influenzato dalla retinite pigmentosa e dall’invecchiamento“, afferma Tsang.
Fonte: Cell Reports Medicine