Immagine: Public Domain.
Un gene associato alla malattia di Parkinson regola l’omeostasi mitocondriale, influenzando così l’immunità innata.
La malattia di Parkinson è un disturbo motorio causato dalla perdita di uno specifico sottoinsieme di neuroni localizzati nel mesencefalo e dall’accumulo di una proteina chiamata α-sinucleina. I meccanismi sottostanti che portano alla morte dei neuroni del mesencefalo non sono ancora ben compresi. Tuttavia, molti individui con malattia di Parkinson hanno livelli aumentati di infiammazione nel cervello e negli organi periferici, come l’intestino. Questa infiammazione è ora vista come un potenziale contributore alla malattia di Parkinson e non solo come risultato di essa.
Le mutazioni nel gene che codifica per la chinasi LRRK2 sono la causa genetica più comune della malattia di Parkinson ereditaria (Singleton et al., 2013). I polimorfismi a singolo nucleotide in questo gene sono anche associati a una maggiore suscettibilità a malattie infiammatorie come la lebbra, la tubercolosi e la malattia dell’intestino irritabile. Prove crescenti suggeriscono che le mutazioni in LRRK2 contribuiscono alle alterazioni immunitarie sia negli organi periferici che nel cervello, ma i meccanismi attraverso i quali LRRK2 regola queste risposte immunitarie sono poco conosciuti.
A parte il suo legame con l’infiammazione, LRRK2 è stato anche implicato nell’attività dei mitocondri, che sono organelli subcellulari chiave legati alla malattia di Parkinson. Ad esempio, le cellule staminali neurali derivate dalla pelle di individui portatori di una mutazione associata alla malattia di Parkinson nel gene per LRRK2 mostrano un aumento del danno al DNA mitocondriale e un aumento del danno ossidativo. Nonostante ciò, il contributo di LRRK2 alla salute mitocondriale nelle cellule del sistema immunitario periferico è stato sottovalutato. Ora Robert Watson e colleghi della Texas A&M University – inclusi Chi Weindel e Samantha Bell come primi autori congiunti – riferiscono che la capacità di LRRK2 di influenzare le risposte infiammatorie nelle cellule immunitarie periferiche è direttamente collegata al suo ruolo nel mantenimento dell’omeostasi mitocondriale.
Per studiare il ruolo di LRRK2 nelle risposte immunitarie periferiche, Weindel et al. hanno isolato i macrofagi dal midollo osseo di topi privi del gene che codifica per l’omologo murino di LRRK2 ( macrofagi knockout Lrrk2 ). Rispetto ai macrofagi con una singola copia di questo gene ( Lrrk2 HETs), i macrofagi knockout sovraregolano i geni normalmente stimolati dagli interferoni (proteine di segnalazione che reclutano le cellule immunitarie per innescare una risposta immunitaria). Weindel et al. hanno anche scoperto che questi macrofagi non erano in grado di sovraregolare i geni di risposta dell’interferone quando erano infettati da micobatteri, probabilmente perché questi geni erano già cronicamente attivati.
Inoltre, quando i topi privi di Lrrk2 sono stati infettati da Mycobacterium tuberculosis, che causa la tubercolosi, i loro polmoni hanno mostrato un’infiammazione locale esacerbata causata dall’infezione. Tuttavia, non sono state osservate differenze nell’esito dell’infezione in questi topi rispetto agli HET Lrrk2. Ciò contraddice precedenti rapporti che suggerivano che i topi privi di Lrrk2 possono fermare la replicazione di M. tuberculosis in modo più efficace rispetto ai topi wild-type, correlata con l’aumento dell’infiammazione nei polmoni. Una possibile ragione di questa incoerenza è che Weindel et al. hanno usato Lrrk2 controlli eterozigoti rispetto ai controlli wild-type. Inoltre, nei due studi sono stati utilizzati diversi ceppi di M. tuberculosis e vi erano anche differenze nel numero di batteri a cui i topi erano esposti durante l’infezione.
Vedi anche:Una tecnologia all’avanguardia smaschera le proteine legate al morbo di Parkinson
Poiché LRRK2 è anche coinvolto nell’attività mitocondriale, Weindel et al. hanno successivamente ha esaminato i mitocondri nei macrofagi knockout Lrrk2. I mitocondri sono organelli dinamici che possono dividersi (frammentarsi) o fondersi a seconda dello stato della cellula. Quando una cellula è stressata, i mitocondri si fondono insieme per scambiare DNA danneggiato e mantenere attiva la respirazione aerobica. Weindel et al. hanno osservato che nei macrofagi privi di Lrrk2, i mitocondri non si fondevano, rendendo i macrofagi più suscettibili allo stress e portando al DNA mitocondriale che fuoriesce nel citosol. Ciò era dovuto, in parte, all’aumentata attivazione di DRP1, una proteina che aiuta a frammentare i mitocondri. L’inibizione di DRP1 ha salvato con successo questi mitocondri anormali in macrofagi Lrrk2 knockout. Weindel et al. hanno anche riportato livelli ridotti di antiossidanti, un accumulo concomitante di specie reattive dell’ossigeno e un aumento dello stress mitocondriale nei macrofagi privi di Lrrk2. Il trattamento di questi macrofagi con antiossidanti ha alleviato lo stress mitocondriale ( Figura 1 ).
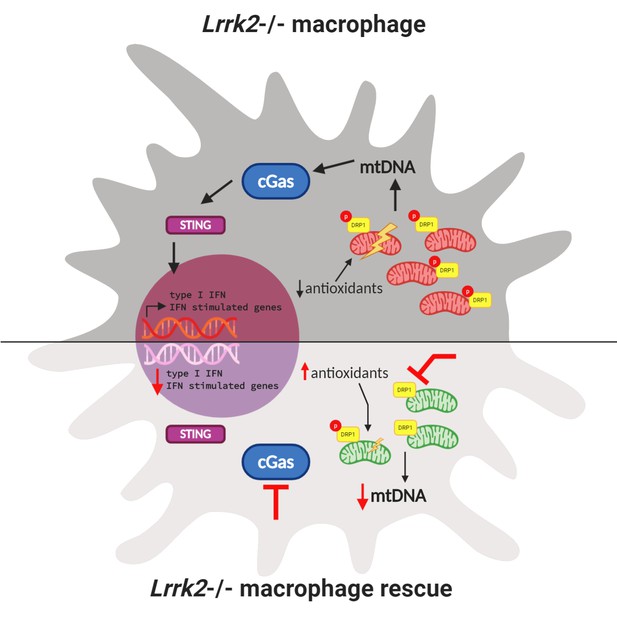
Interazioni tra omeostasi mitocondriale e risposta immunitaria in un macrofago knockout Lrrk2 .
(In alto) La perdita di Lrrk2 nei macrofagi di topo aumenta la fosforilazione di DRP1. Ciò porta ad un aumento del livello di DNA mitocondriale (mtDNA; strutture a forma di fagiolo rosso) nel citosol, che …
Maggiore DNA mitocondriale nel citosol di macrofafi LRRK2 knockout ha condotto Weindel et al. ipotizzare che l’incapacità di regolare l’omeostasi mitocondriale possa contribuire all’attivazione cronica dei geni di risposta dell’interferone. Il percorso cGAS – STING è una parte del sistema immunitario innato che innesca l’espressione di geni infiammatori quando il DNA viene rilevato nel citosol. Weindel et al. hanno mostrato che la perdita del gene cGas ha ridotto i livelli basali dell’interferone di tipo I nei macrofagi knockout Lrrk2 e ha corretto la risposta agli stimoli immunitari ( Figura 1 ).
Questi risultati collegano il ruolo di LRRK2 nella disregolazione immunitaria innata con la sua funzione critica nel mantenere l’omeostasi mitocondriale per la prima volta e hanno implicazioni più ampie per il campo della malattia di Parkinson.
La ricerca futura probabilmente studierà come le mutazioni nel gene LRRK2 influenzano la relazione tra mitocondri e infiammazione nelle cellule immunitarie. La più comune di queste mutazioni causa un aumento tossico dell’attività della chinasi, quindi gli inibitori della chinasi sono stati considerati per i loro potenziali effetti terapeutici nella malattia di Parkinson. Tuttavia, dato che la perdita di LRRK2 può portare a maggiori rischi di infezione e infiammazione nelle cellule del sangue periferico, le finestre terapeutiche dovranno essere attentamente monitorate per evitare effetti indesiderati sul sistema immunitario.
Fonte:eLifesciences