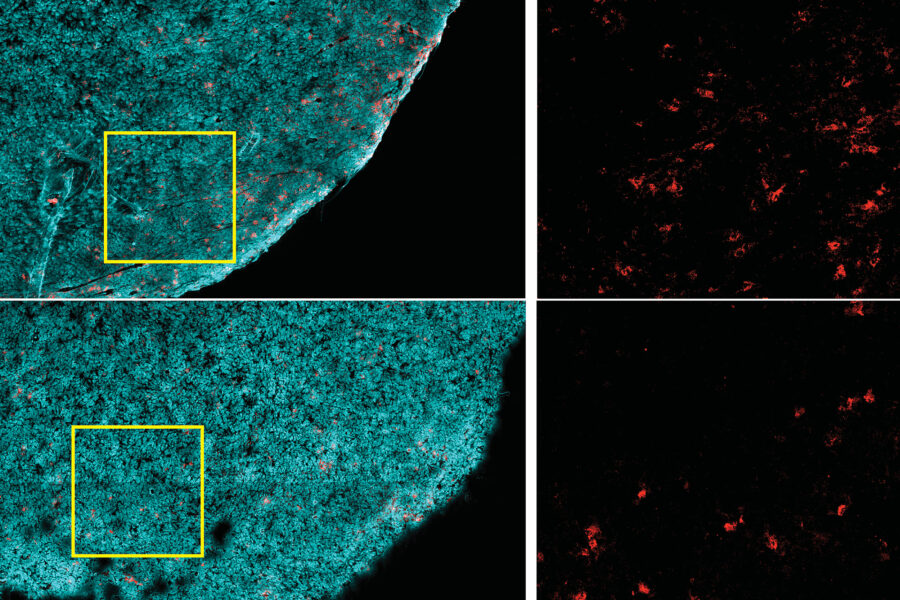
(Obesità e cancro-Immagine: le cellule tumorali sono contrassegnate in ciano e le cellule T CD8 + in rosso. In alto c’è un tumore di un animale che segue una dieta normale. Sul fondo c’è un tumore di un animale che segue una dieta ricca di grassi. Ci sono significativamente meno cellule T CD8 + nel tumore obeso.Credito: Ringel et al, 2020).
L’obesità è stata collegata a un aumento del rischio di oltre una dozzina di diversi tipi di cancro, nonché a prognosi e sopravvivenza peggiori. Nel corso degli anni, gli scienziati hanno identificato i processi correlati all’obesità che guidano la crescita del tumore, come i cambiamenti metabolici e l’infiammazione cronica, ma una comprensione dettagliata dell’interazione tra obesità e cancro è rimasta sfuggente.
Ora, in uno studio sui topi, i ricercatori della Harvard Medical School (HMS) hanno scoperto un nuovo pezzo di questo puzzle, con implicazioni sorprendenti per l’immunoterapia contro il cancro: l‘obesità consente alle cellule tumorali di superare le cellule immunitarie che uccidono il tumore in una battaglia per il “carburante”.
Lo studio, riportato in Cell il 9 dicembre, dimostra che una dieta ricca di grassi riduce il numero e l’attività antitumorale delle cellule T CD8 +, un tipo critico di cellula immunitaria, all’interno dei tumori. Ciò si verifica perché le cellule tumorali riprogrammano il loro metabolismo in risposta all’aumento della disponibilità di grasso per assorbire meglio le molecole di grasso ricche di energia, privando le cellule T di carburante e accelerando la crescita del tumore.
“Mettere lo stesso tumore in contesti obesi e non obesi rivela che le cellule tumorali ricollegano il loro metabolismo in risposta a una dieta ricca di grassi”, ha detto Marcia Haigis, Professore di biologia cellulare presso il Blavatnik Institute dell’HMS e co-autore senior dello studio. “Questa scoperta suggerisce che una terapia che potrebbe funzionare in un ambiente potrebbe non essere altrettanto efficace in un altro, il che deve essere compreso meglio data l’epidemia di obesità nella nostra società”.
Il team ha scoperto che il blocco di questa riprogrammazione metabolica correlata al grasso ha ridotto significativamente il volume del tumore nei topi alimentati con diete ad alto contenuto di grassi. Poiché le cellule T CD8 + sono la principale arma utilizzata dalle immunoterapie che attivano il sistema immunitario contro il cancro, i risultati dello studio suggeriscono nuove strategie per migliorare tali terapie.
“Le immunoterapie contro il cancro stanno avendo un impatto enorme sulla vita dei pazienti, ma non portano benefici a tutti”, ha detto la co-autrice senior dello studio Arlene Sharpe, Professore di Patologia Comparata dell’HMS George Fabyan e Presidente del Dipartimento di Immunologia dell’Istituto Blavatnik.
“Ora sappiamo che c’è un tiro alla fune metabolico tra le cellule T e le cellule tumorali che cambia con l’obesità“, ha detto Sharpe. “Il nostro studio fornisce una tabella di marcia per esplorare questa interazione che può aiutarci a iniziare a pensare alle immunoterapie contro il cancro e alle terapie combinate in modi nuovi“.
Haigis, Sharpe e colleghi hanno studiato gli effetti dell’obesità su modelli murini di diversi tipi di cancro, inclusi il colon-retto, il seno, il melanoma e il polmone. Guidato dai primi autori dello studio Alison Ringel e Jefte Drijvers, il team ha sottoposto i topi a diete normali o a diete ad alto contenuto di grassi, quest’ultime hanno portato ad un aumento del peso corporeo e ad altri cambiamenti legati all’obesità. I ricercatori hanno quindi esaminato diversi tipi di cellule e molecole all’interno e intorno ai tumori, chiamati insieme microambiente tumorale.
“Paradosso del grasso”
I ricercatori hanno scoperto che i tumori crescevano molto più rapidamente negli animali trattati con diete ricche di grassi rispetto a quelli con diete normali. Ma questo si è verificato solo nei tipi di cancro immunogenici, che possono contenere un numero elevato di cellule immunitarie; sono più facilmente riconoscibili dal sistema immunitario e hanno maggiori probabilità di provocare una risposta immunitaria.
Gli esperimenti hanno rivelato che le differenze legate alla dieta nella crescita del tumore dipendevano specificamente dall’attività delle cellule T CD8 +, cellule immunitarie che possono colpire e uccidere le cellule tumorali. La dieta non ha influenzato il tasso di crescita del tumore se le cellule T CD8 + sono state eliminate sperimentalmente nei topi.
Sorprendentemente, le diete ad alto contenuto di grassi hanno ridotto la presenza di cellule T CD8 + nel microambiente tumorale, ma non in altre parti del corpo. Quelli rimasti nel tumore erano meno robusti: si dividevano più lentamente e avevano marcatori di attività ridotta. Ma quando queste cellule sono state isolate e coltivate in laboratorio, avevano un’attività normale, suggerendo che qualcosa nel tumore ha compromesso la funzione di queste cellule.
Il team ha anche riscontrato un apparente paradosso. Negli animali obesi, il microambiente tumorale era impoverito di acidi grassi liberi chiave, una delle principali fonti di combustibile cellulare, anche se il resto del corpo era arricchito di grassi, come previsto per l’obesità.
Questi indizi hanno spinto i ricercatori a creare un atlante completo dei profili metabolici di diversi tipi di cellule nei tumori in condizioni di dieta normale e ricca di grassi.
Le analisi hanno rivelato che le cellule tumorali si sono adattate in risposta ai cambiamenti nella disponibilità di grasso. Sotto una dieta ricca di grassi, le cellule tumorali sono state in grado di riprogrammare il loro metabolismo per aumentare l’assorbimento e l’utilizzo dei grassi, mentre le cellule T CD8 + no. Questo alla fine ha impoverito il microambiente tumorale di alcuni acidi grassi, lasciando i linfociti T affamati di questo combustibile essenziale.
“Il paradossale esaurimento degli acidi grassi è stato uno dei risultati più sorprendenti di questo studio. Ci ha davvero sconvolti ed è stato il trampolino di lancio per le nostre analisi “, ha detto Ringel, un borsista post-dottorato nel laboratorio di Haigis. “Il fatto che l’obesità e il metabolismo di tutto il corpo possano cambiare il modo in cui le diverse cellule dei tumori utilizzano il carburante è stata una scoperta entusiasmante e il nostro atlante metabolico ora ci consente di sezionare e comprendere meglio questi processi”.
Obesità: PGH3 e il metabolismo dei grassi
Attraverso diversi approcci, tra cui analisi dell’espressione genica di una singola cellula, indagini sulle proteine su larga scala e imaging ad alta risoluzione, il team ha identificato numerosi cambiamenti legati alla dieta e alle vie metaboliche sia del cancro che delle cellule immunitarie nel microambiente tumorale.
Di particolare interesse è stata PHD3, una proteina che nelle cellule normali ha dimostrato di agire da freno all’eccessivo metabolismo dei grassi. Le cellule tumorali in un ambiente obeso avevano un’espressione significativamente inferiore di PHD3 rispetto a un ambiente normale. Quando i ricercatori hanno costretto le cellule tumorali a sovraesprimere PHD, hanno scoperto che questo diminuiva la capacità di un tumore di assorbire il grasso nei topi obesi. Ha anche ripristinato la disponibilità dei principali acidi grassi liberi nel microambiente tumorale.
Vedi anche:L’obesità infantile potrebbe aumentare il rischio di sclerosi multipla
L’aumento dell’espressione di PHD3 ha ampiamente invertito gli effetti negativi di una dieta ricca di grassi sulla funzione delle cellule immunitarie nei tumori. I tumori con elevati livelli di PHD3 sono cresciuti più lentamente nei topi obesi rispetto ai tumori con bassi livelli di PHD3. Questo è stato un risultato diretto dell’aumentata attività delle cellule T CD8 +. Nei topi obesi privi di cellule T CD8 +, la crescita del tumore non è stata influenzata dalle differenze nell’espressione di PHD3.
Il team ha anche analizzato i database dei tumori umani e ha scoperto che una bassa espressione di PHD3 era associata a tumori immunologicamente “freddi”, definiti da un minor numero di cellule immunitarie. “Questa associazione ha suggerito che il metabolismo dei grassi tumorali gioca un ruolo nella malattia umana e che l’obesità riduce l’immunità antitumorale in più tipi di cancro”, hanno detto gli autori.
“Le cellule T CD8 + sono al centro di molte promettenti terapie antitumorali di precisione, compresi i vaccini e le terapie cellulari come CAR-T”, ha detto Sharpe. “Questi approcci richiedono che le cellule T abbiano energia sufficiente per uccidere le cellule tumorali, ma allo stesso tempo non vogliamo che i tumori abbiano il carburante per crescere. Ora disponiamo di dati straordinariamente completi per studiare questi meccanismi dinamici e determinanti che impediscono alle cellule T di funzionare come dovrebbero”.
“Più in generale, i risultati servono come base per gli sforzi per comprendere meglio come l’obesità influisce sul cancro e l’impatto del metabolismo del paziente sui risultati terapeutici”, hanno detto gli autori. “Sebbene sia troppo presto per dire se PHD3 è il miglior target terapeutico, i risultati aprono la porta a nuove strategie per combattere il cancro attraverso le sue vulnerabilità metaboliche”, hanno detto gli autori.
“Siamo interessati a identificare percorsi che potremmo utilizzare come potenziali bersagli per prevenire la crescita del cancro e per aumentare la funzione antitumorale immunitaria“, ha detto Haigis. “Il nostro studio fornisce un atlante metabolico ad alta risoluzione da estrarre per approfondimenti sull’obesità, l’immunità tumorale, il crosstalk e la competizione tra cellule immunitarie e tumorali. Probabilmente ci sono molti altri tipi di cellule e molti altri percorsi da esplorare”.
Altri autori dello studio includono Gregory Baker, Alessia Catozzi, Juan García-Cañaveras, Brandon Gassaway, Brian Miller, Vikram Juneja, Thao Nguyen, Shakchhi Joshi, Cong-Hui Yao, Haejin Yoon, Peter Sage, Martin LaFleur, Justin Trombley, Connor Jacobson, Zoltan Maliga, Steven Gygi, Peter Sorger e Joshua Rabinowitz.
Questo studio è stato sostenuto dal National Cancer Institute e dal National Institute of Diabetes and Digestive and Kidney Diseases of the National Institutes of Health (sovvenzioni U54-CA225088, R01CA213062, R01DK103295, P01AI56299, 5F31CA224601 e T32CA207021), Ludwig Center presso Harvard Medical School, l’Evergrande Center for Immunologic Disease, la Glenn Foundation for Medical Research e l’American Cancer Society.
Fonte:newsHarvard