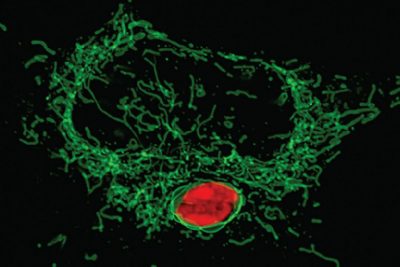
Mitocondri-immagine: i mitocondri dell’ospite (verdi) circondano l’intruso parassita Toxoplasma (rosso). Credit UCLA.
I mitocondri sono centri chiave del metabolismo cellulare. Ciò significa che, oltre a generare una serie di metaboliti, questi organelli utilizzano e consumano anche molti nutrienti di cui i patogeni invasori hanno bisogno. Sebbene i mitocondri siano presenti in centinaia o addirittura migliaia nelle cellule dei mammiferi – a differenza dei pochi patogeni invasori – non è ancora chiaro se le cellule ospiti sfruttino i mitocondri per limitare l’accesso dei patogeni ai metaboliti essenziali.
Avete sentito dire che i mitocondri sono la “centrale elettrica della cellula”. Ora preparatevi a dire che “i mitocondri sono la fanteria della cellula!” .
I microbiologi dell’UCLA hanno scoperto che, oltre a produrre energia per la cellula, i mitocondri contribuiscono anche a ridurre le infezioni. I loro risultati, pubblicati su Science, mostrano che i mitocondri “affamano” i patogeni competendo con loro per la vitamina B9 (folato) per prevenire le infezioni. I ricercatori hanno scoperto che il folato utilizzato dai mitocondri come parte del loro normale metabolismo riduceva la quantità di folato disponibile per uno specifico parassita, il Toxoplasma gondii, che di conseguenza cresceva più lentamente.
Il Toxoplasma gondii è un microrganismo parassita trasmesso dalle feci di gatto o dalla carne poco cotta che causa la toxoplasmosi, un’infezione spesso asintomatica, ma che può essere particolarmente pericolosa per le persone immunodepresse e durante la gravidanza. Nei topi, l’infezione da T. gondii provoca alterazioni cerebrali e alcuni ricercatori ritengono che il parassita abbia una relazione simbiotica con i gatti, che non ne sono colpiti, ma traggono beneficio da prede più facili da catturare. Gli esseri umani possono manifestare alterazioni cerebrali simili, come una maggiore tolleranza all’odore dell’urina di gatto. Per gli esseri umani, il rischio molto maggiore è l’infezione di un feto in crescita, che può causare uno sviluppo improprio di alcuni organi interni.
“Abbiamo ipotizzato che i processi mitocondriali che si basano su diversi metaboliti citosolici potrebbero rivelare richieste metaboliche concorrenti tra mitocondri e patogeni intracellulari. Ci siamo concentrati sulla replicazione del DNA mitocondriale (mtDNA), che richiede nutrienti, inclusi quelli che mantengono i processi metabolici a un atomo di carbonio necessari per la biosintesi dei nucleotidi. Abbiamo scoperto che l’infezione con il parassita intracellulare Toxoplasma gondii aumentava il numero di copie di mtDNA. Questa risposta era indipendente dalla biogenesi mitocondriale, ma richiedeva l’attivazione del fattore di trascrizione 4 (ATF4), che veniva attivato attraverso la chinasi HRI della risposta integrata allo stress (ISR) in risposta allo stress mitocondriale indotto dall’effettore del parassita“, spiegano gli autori.
La nuova scoperta solleva la possibilità che un regime vitaminico possa riprogrammare il metabolismo mitocondriale per renderlo ancora più efficace nella prevenzione di infezioni, come la toxoplasmosi, negli esseri umani.
“Molte persone pensano ai mitocondri come a delle fabbriche di energia e che i patogeni possano semplicemente sfruttarne la potenza consumando l’energia che generano. Ma la realtà è che i mitocondri sono in realtà una specie di batteri addomesticati che competono con i patogeni invasori per i nutrienti”, dice Lena Pernas, autrice corrispondente e Professoressa di microbiologia, immunologia e genetica molecolare presso l’UCLA.
I mitocondri si sono evoluti molto tempo fa, quando un antico batterio è entrato in una cellula e ha stabilito una relazione simbiotica in cui ha ricevuto i nutrienti di cui aveva bisogno per vivere e la cellula ha ricevuto l’energia che produceva attraverso il suo metabolismo. Attraverso questo processo, chiamato endosimbiosi, i batteri si sono evoluti nei mitocondri che esistono oggi. Poiché hanno avuto origine come batteri, i mitocondri contengono ancora DNA, chiamato DNA mitocondriale, o mtDNA, che è distinto dal DNA nucleare.
“Se pensiamo ai mitocondri come a batteri intracellulari addomesticati che vogliono proteggere le loro cellule da nuovi invasori, qual è un modo molto semplice per farlo?” ha detto Pernas. “Beh, potrebbero consumare i nutrienti di cui gli invasori hanno bisogno. E ci sono centinaia o migliaia di mitocondri per cellula e probabilmente solo pochi invasori iniziali in un dato momento, il che significa che potrebbero non rimanere molti nutrienti per gli invasori”.
Questa nuova scoperta è nata quando la prima autrice Tânia Catarina Medeiros, borsista post-dottorato nel gruppo di Pernas presso il suo precedente istituto, il Max Planck Institute for Biology of Ageing, ha notato che la quantità di mtDNA nei mitocondri aumentava durante un’infezione. Infettando cellule umane in coltura con T. gondii, i ricercatori hanno scoperto un aumento della produzione di una proteina chiamata ATF4 che regola l’espressione genica e che viene attivata da stress come microbi invasori. ATF4 ha portato a un aumento della quantità di mtDNA, ma ha anche indicato che la cellula era in grado di rilevare la presenza del patogeno, che ha attivato una risposta che ha aumentato il metabolismo mitocondriale. La cellula è stata in grado di farlo perché poteva effettivamente rilevare le proteine secernete dal parassita.
“I patogeni hanno un arsenale di effettori, ovvero proteine che entrano nella cellula ospite e ne perturbano la funzione. Ma la cellula ospite è stata in grado di dire ai mitocondri: ‘Ehi, stiamo rilevando le proteine di questo invasore. Attiviamo questa risposta’“, ha affermato Pernas.
Per scoprire se i parassiti traessero beneficio dall’aumento del metabolismo mitocondriale, i ricercatori hanno eliminato ATF4 e hanno scoperto che i parassiti reagivano meglio quando il metabolismo mitocondriale era inalterato. Ciò ha dimostrato che l’aumento del metabolismo, che era una risposta all’infezione, stava in realtà contribuendo a sopprimere l’infezione.
Ulteriori indagini hanno rivelato che l’accelerato metabolismo mitocondriale consumava più folato, di cui il parassita ha bisogno per il suo particolare modo di produrre nucleotidi, i mattoni fondamentali del DNA. Senza la capacità di produrre questo fondamentale elemento, i parassiti T. gondii crescevano più lentamente.
“C’è una competizione nutrizionale in cui il nostro microbo addomesticato fa morire di fame il microbo invasore“, ha affermato Pernas.
Lo studio è il primo a identificare un percorso dell’ospite che attiva la competizione nutrizionale mitocondriale e a dimostrare che svolge un ruolo nella prevenzione delle infezioni.
Leggi anche:Squilibrio del proteoma da aneuploidia collegato alla disfunzione mitocondriale
CONCLUSIONE
Abstract grafico

“Penso che questo potrebbe applicarsi a qualsiasi microbo che dipenda dall’acido folico per produrre quel particolare nucleotide”, ha affermato Pernas. “Questo includerebbe, ad esempio, il Plasmodium, che causa la malaria. In futuro, potremo chiederci se la restrizione dell’acido folico attraverso il metabolismo mitocondriale difenda da altri tipi di infezioni”.