(Cancro-Immagine: astratto grafico. Credito: rapporti cellulari (2022). DOI: 10.1016/j.celrep.2022.110448).
Gli scienziati del Roswell Park Comprehensive Cancer Center hanno fatto luce su un modo diverso di superare i meccanismi di resistenza a specifici agenti terapeutici usati per curare il cancro. In un nuovo articolo pubblicato il 1 marzo sulla rivista Cell Reports, i ricercatori propongono un nuovo approccio al trattamento del cancro basato sul modo in cui le diverse cellule tumorali si dividono.
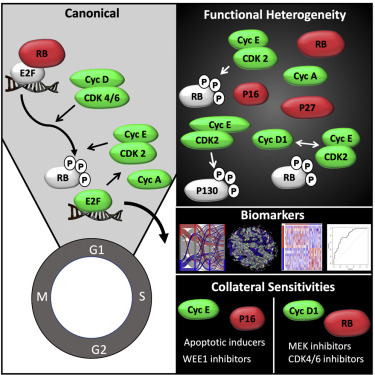
Un team collaborativo guidato da Agnieszka Witkiewicz, MD, Professore di Oncologia e da Erik Knudsen, Ph.D., Professore di Oncologia e Cattedra di Biologia Molecolare e Cellulare, di Roswell Park ha studiato oltre 500 linee cellulari da una moltitudine di tipi di cancro, come così come modelli tumorali preclinici. I ricercatori hanno quindi analizzato le cellule tumorali in base alla loro dipendenza da CDK e CCN, due geni che guidano il ciclo cellulare e determinano la frequenza con cui una cellula tumorale si divide.
“Abbiamo scoperto che il modo in cui le cellule tumorali si dividono è molto vario e che la diversità rappresenta una sfida enorme per alcune terapie antitumorali ampiamente utilizzate perché spesso contribuisce alla resistenza al trattamento”, afferma il Dott. Witkiewicz, autore senior dello studio. “Tuttavia, con una migliore comprensione di queste caratteristiche eterogenee della divisione cellulare del cancro, diverse terapie potrebbero essere implementate in modo più preciso ed efficace”.
Vedi anche:Cancro: le statine rallentano le metastasi
Utilizzando analisi biochimiche avanzate e sequenziamento genetico, il team ha scoperto grandi differenze nella richiesta di CDK e CCN tra linee cellulari e tipi cellulari, evidenziando la natura complessa ed eterogenea dei cicli cellulari. I ricercatori hanno anche identificato specifiche vulnerabilità genetiche e farmaceutiche per ciascun metodo di divisione cellulare, aprendo la porta a tipi più precisi di interventi terapeutici per superare la resistenza al trattamento.
Spiegano gli autorei:
“Il ciclo cellulare è guidato dall’azione delle chinasi ciclina-dipendenti (CDK). Convenzionalmente, le cicline di tipo D (cicline D1, D2 o D3) si accumulano in risposta a segnali mitogeni fisiologici o segnali oncogenici che guidano la proliferazione cellulare. Queste cicline interagiscono preferenzialmente con CDK4 o CDK6 per produrre complessi attivi. L’attività catalitica CDK4/6 è considerata chiave per avviare la progressione attraverso le fasi G1/S del ciclo cellulare, che è mediata da queste chinasi che guidano la fosforilazione del soppressore tumorale del retinoblastoma (RB) e delle proteine correlate (p107 e p130). La famiglia di proteine RB funziona come co-repressori trascrizionali e serve a inibire la proliferazione impedendo l’espressione dei geni necessari per la progressione del ciclo cellulare che sono sotto il controllo della famiglia di fattori di trascrizione E2F o FOXM1. I tumori privi del soppressore tumorale RB sono indipendenti da CDK4/6 e resistente agli inibitori farmacologici CDK4/6 come Palbociclib. Coerentemente con questa resistenza, molti tumori carenti di RB esprimono livelli elevati dell’inibitore CDK4/6 p16 ink4a. Questi dati supportano il concetto che RB rappresenta il substrato chiave per i complessi CDK4/6 nel guidare la divisione cellulare. Oltre a CDK4/6, CDK2 svolge un ruolo importante nel coordinare la progressione del ciclo cellulare. CDK2 attraverso il legame con la ciclina E o la ciclina A può promuovere la progressione del ciclo cellulare nelle fasi G1, S o G2 del ciclo cellulare. Mentre CDK2 può apparentemente fosforilare RB , CDK4/6 è visto come adescamento della fosforilazione di RB. L’esatta relazione di CDK4/6 e CDK2 nel guidare l’iperfosforilazione di RB rimane poco chiara e le forme mono e parzialmente fosforilate di RB complicano ulteriormente quello che è stato ampiamente considerato come un interruttore binario per la proliferazione. Contro questi risultati, il requisito specifico e/o la sufficienza di CDK2 nel guidare la fosforilazione di RB e la progressione del ciclo cellulare è rimasto poco chiaro, con risultati differenziali che potrebbero riflettere il contesto cellulare. L’attivazione di RB può agire per limitare l’attività di CDK2 controllando l’espressione della ciclina E e della ciclina A. Pertanto, convenzionalmente, il ciclo cellulare è considerato relativamente lineare, in cui CDK4/6, attraverso la fosforilazione di RB e proteine correlate, controlla l’attività di CDK2 come riassunto in più revisioni“.
“Prendere di mira il ciclo cellulare come mezzo per curare il cancro è interessante, poiché la crescita cellulare incontrollata è alla base di quasi tutti i tumori“, aggiunge il dott. Witkiewicz. “Le cellule tumorali hanno sviluppato meccanismi di resistenza ad alcuni dei nostri trattamenti contro il cancro più utilizzati, ma con i progressi nel rilevamento di biomarcatori associati a tale resistenza, riteniamo di poter progettare interventi terapeutici mirati e più precisi che superano la resistenza al trattamento“.
Fonti:Cell Reports