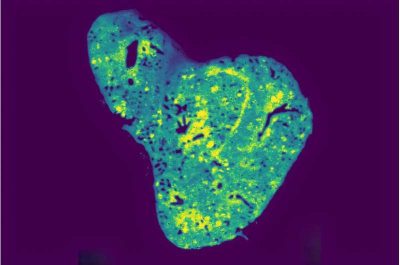
Cancro al seno-Imaging metablomico spaziale del glutatione nel polmone di un topo con metastasi. Crediti: Birsoy Lab
I mitocondri possono essere la centrale elettrica della cellula, ma prove sempre più numerose suggeriscono che questo organello sia anche una forza trainante del cancro. Ora, nuove prove puntano al metabolita mitocondriale glutatione, evidenziandone il ruolo centrale nell’aiutare le cellule del cancro al seno a staccarsi dal tumore primario, diffondersi nell’organismo e radicarsi in altri tessuti.
Questi risultati sono tra i primi a collegare uno specifico metabolita mitocondriale alle metastasi, con importanti implicazioni per lo studio del cancro a livello cellulare. “Ci auguriamo che il nostro lavoro porti maggiore attenzione sulla rilevanza degli organelli e dei loro metaboliti per la biologia del cancro“, afferma Kivanç Birsoy, responsabile del Laboratorio di Regolazione Metabolica e Genetica del Rockefeller Center.
Un misterioso collegamento con le metastasi
La stragrande maggioranza dei decessi per cancro è dovuta alla sua diffusione, piuttosto che alle complicazioni del tumore originale. Consapevoli che le metastasi sono alla base della mortalità per cancro, i ricercatori hanno trascorso decenni cercando di identificare – e sconfiggere – i fattori specifici che consentono alle cellule anomale di staccarsi dal tumore primario e colonizzare il resto del corpo.
I metaboliti svolgono un ruolo chiave: studi precedenti hanno dimostrato che i metaboliti lattato, piruvato, glutammina e serina supportano ciascuno stadi distinti di metastasi. E poiché i mitocondri all’interno della cellula tumorale sono responsabili non solo della produzione di energia, ma anche della produzione di metaboliti, non sorprende che una manciata di studi recenti abbia collegato l‘attività mitocondriale alle metastasi nei tumori al seno, ai reni e al pancreas.
Tuttavia, i ricercatori non erano riusciti a identificare i meccanismi precisi in gioco. “I mitocondri contengono migliaia di metaboliti, ed è stato difficile determinare quali siano importanti per la formazione e la crescita del tumore e quali diano inizio alle metastasi”, afferma Birsoy.
Cellule sotto stress
Nel loro studio, ora pubblicato su Cancer Discovery, Birsoy e colleghi hanno utilizzato una strategia innovativa che prevedeva l’etichettatura proteica in grado di distinguere le cellule tumorali primarie da quelle migrate dal seno al polmone. Il team, guidato dalla borsista laureata Nicole DelGaudio e dalla borsista post-dottorato Hsi-wen Yeh, ha poi analizzato i metaboliti in questi organelli per rivelare come i metaboliti mitocondriali si modificano quando le cellule tumorali colonizzano nuovi siti.
“Queste tecniche ci hanno permesso di vedere in modo imparziale la differenza tra ciò che è essenziale nella metastasi e ciò che è essenziale nel tumore primario“, afferma DelGaudio.
Tra migliaia di composti mitocondriali, uno spiccava: il glutatione. Un importante antiossidante coinvolto nella riduzione dello stress ossidativo, nel miglioramento della disintossicazione metabolica e nella regolazione del sistema immunitario, i cui livelli sono aumentati vertiginosamente nelle cellule tumorali metastatiche che hanno invaso il polmone. Per confermare ulteriormente i risultati, il team ha utilizzato una tecnica di metabolomica spaziale che ha permesso di visualizzare la distribuzione del glutatione direttamente all’interno dei tessuti polmonari.
I ricercatori hanno poi spostato la loro attenzione sulle proteine della membrana mitocondriale, individuando trasportatori che si sono rivelati essenziali per le cellule metastatiche in crescita nel polmone. Ancora una volta, è emerso un chiaro precursore: SLC25A39, il trasportatore mitocondriale del glutatione. I risultati hanno chiuso il cerchio, collegando un metabolita e il suo trasportatore alle metastasi, dimostrando che l‘importazione di glutatione mitocondriale tramite il trasportatore SLC25A39 è essenziale per la diffusione del cancro.
Birsoy e colleghi hanno anche scoperto come il glutatione mitocondriale stimoli la diffusione del cancro: non agendo come antiossidante – un effetto escluso da numerosi esperimenti – ma segnalando l’attivazione di ATF4, un fattore di trascrizione che aiuta le cellule tumorali a sopravvivere in condizioni di scarsa ossigenazione. Questo ha anche individuato quando il glutatione è specificamente necessario: durante le prime fasi della colonizzazione metastatica, quando le cellule tumorali si adattano rapidamente all’ambiente stressante di un nuovo tessuto.
Un colpevole familiare
Questo lavoro si basa su recenti e significativi lavori del laboratorio di Birsoy. Nel 2021, il suo team è stato il primo a dimostrare che SLC25A39 è il trasportatore che trasporta il glutatione nei mitocondri; nel 2023, hanno dimostrato che SLC25A39 non è solo un trasportatore, ma un sensore dinamico che regola la quantità di glutatione nei mitocondri e ne regola di conseguenza i livelli. Quindi, quando questo metabolita e il suo trasportatore mitocondriale sono comparsi negli screening per il cancro, Birsoy sapeva come proseguire con i suoi esperimenti.
“Poiché avevamo scoperto questo trasportatore in precedenza e sapevamo come bloccare l’ingresso del glutatione, avevamo già gli strumenti necessari per indagare il suo ruolo nelle metastasi del cancro“, afferma.
I risultati potrebbero avere implicazioni cliniche, soprattutto perché il team ha anche scoperto che i campioni di cancro al seno di pazienti la cui malattia si era diffusa ai polmoni mostravano livelli elevati di SLC25A39 e che una maggiore espressione di SLC25A39 era fortemente correlata a una minore sopravvivenza complessiva nelle pazienti con cancro al seno.
Spiegano gli autori:
“Le cellule tumorali richiedono sostanziali adattamenti metabolici per metastatizzare in organi distanti, ma i metaboliti essenziali per una colonizzazione efficace rimangono poco definiti. In questo studio, abbiamo utilizzato un approccio di metabolomica mitocondriale per confrontare cellule di carcinoma mammario primario e metastatico. Questa analisi ha rivelato un accumulo di glutatione mitocondriale (GSH) durante le metastasi polmonari, guidato dall’elevata espressione di SLC25A39, un trasportatore mitocondriale del GSH. La perdita di SLC25A39 compromette la colonizzazione metastatica negli screening genetici, nei modelli di linee cellulari e negli xenotrapianti derivati da pazienti, senza influenzare la crescita del tumore primario. L’importazione di GSH mitocondriale è specificamente richiesta durante la colonizzazione precoce e funziona indipendentemente dal suo ruolo antiossidante canonico. Gli screening di attivazione CRISPR hanno identificato ATF4, un fattore di trascrizione indotto dallo stress, come un meccanismo di bypass che ripristina il potenziale metastatico nelle cellule con deficit di SLC25A39. Meccanicisticamente, SLC25A39 è necessario per un’attivazione ottimale di ATF4 durante la metastasi e in condizioni di ipossia, collegando la disponibilità di GSH mitocondriale alla segnalazione integrata della risposta allo stress. Questi risultati identificano il GSH mitocondriale come un metabolita necessario e limitante per la progressione metastatica”.
“Un giorno, una piccola molecola che prende di mira questo metabolita bloccandone il trasportatore potrebbe potenzialmente prevenire le metastasi del cancro al seno, con meno effetti collaterali rispetto alle terapie radicali che prendono di mira processi cellulari più generali”, affermano gli autori.
Leggi anche:Cancro al seno: ricercatori invertono la resistenza all’immunoterapia
Nel breve termine, tuttavia, il documento sottolinea l’importanza di definire con precisione il modo in cui i metaboliti nei diversi compartimenti operano all’interno delle nostre cellule.
“Stiamo cercando di rendere più precisa la nostra conoscenza del metabolismo”, afferma Birsoy. “Non si tratta solo di alcuni livelli di metaboliti che aumentano e altri che diminuiscono. Dobbiamo analizzare gli organelli, i compartimenti precisi, per capire come i metaboliti influenzano la salute umana“.
Fonte:Cancer Discovery