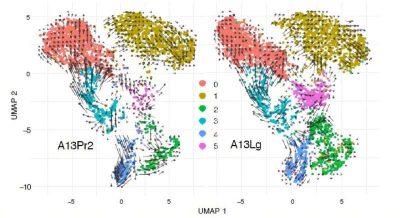
Cancro al pancreas-immagine: rappresentazione dei modelli di espressione di KLF5 nelle cellule tumorali pancreatiche umane coltivate in laboratorio (a sinistra) e dei loro modelli di migrazione dal tumore primario (a destra). Crediti: laboratorio Andrew Feinberg, Johns Hopkins Medicine.
Uno dei principali enigmi della ricerca e del trattamento del cancro è che le metastasi che portano alla morte nella maggior parte dei pazienti, non sembrano coinvolgere ulteriori mutazioni driver.
In uno studio su cellule coltivate in laboratorio incentrato su potenziali nuovi obiettivi di trattamento per arrestare la diffusione della maggior parte dei tumori al pancreas, gli scienziati della Johns Hopkins Medicine riferiscono di aver scoperto che un gene chiamato KLF5 (fattore 5 simile a Krueppel) alimenta la crescita di tali tumori in diffusione, non acquisendo cambiamenti anomali nel codice del DNA delle cellule cancerose stesse, ma alterando i cambiamenti chimici e l’organizzazione del DNA o epigenetica, che attiva e disattiva i geni.
“Le alterazioni epigenetiche sono sottovalutate come una delle principali vie per lo sviluppo e l’alimentazione della crescita delle metastasi del cancro”, afferma Andrew Feinberg, MD, Bloomberg Distinguished Professor presso le facoltà di medicina, ingegneria e sanità pubblica della Johns Hopkins University.
Nel 2017, Feinberg ha guidato i ricercatori a dimostrare che le persone affette dalla forma più comune di cancro al pancreas presentavano alterazioni epigenetiche diffuse, a differenza di nuovi cambiamenti nel codice del DNA stesso (mutazioni) nel tumore primario che portavano il cancro a metastatizzare in altre parti del corpo.
Le nuove scoperte, che hanno implicazioni nella ricerca di trattamenti per il cancro al pancreas e altri tumori, li hanno spinti a proseguire con lo studio attuale, pubblicato su Molecular Cancer.
Per lo studio attuale, gli scienziati miravano a individuare i geni più influenti associati alla crescita delle cellule tumorali. Per farlo, hanno utilizzato una tecnologia di alterazione genetica nota come CRISPR per effettuare tagli nel DNA che silenziassero i geni nel loro mirino investigativo. Una volta disattivati, i geni che causavano il maggiore blocco della crescita cellulare erano considerati quelli più influenti sulla crescita cellulare se fossero stati attivati.
Gli scienziati hanno scoperto che KLF5 ha avuto l’effetto maggiore promuovendo specificamente la crescita e l’invasione delle cellule metastatiche e che 10 persone su 13 affette da cancro al pancreas avevano un’espressione genica KLF5 aumentata in almeno una lesione metastatica rispetto ai tumori primari.
Il team di ricerca ha condotto anche altri esperimenti per convalidare l’impatto di KLF5 sulla crescita delle cellule metastatiche e ha scoperto che KLF5 controlla il confezionamento compatto del DNA, un fattore epigenetico che consente l’attivazione o la disattivazione dei geni.
Gli scienziati hanno concluso che lievi cambiamenti nei livelli di espressione di KLF5 nel gruppo di cellule metastatiche sembravano apportare cambiamenti relativamente più ampi nella capacità delle cellule di crescere e diffondersi.
“Ciò potrebbe suggerire che, per sviluppare trattamenti per le metastasi del cancro al pancreas, potrebbe non essere necessario disattivare completamente il gene per ottenere un effetto positivo“, afferma Feinberg, il quale sottolinea che sono in fase di sviluppo diversi composti antitumorali che prendono di mira KLF5.
Leggi anche:Cancro al pancreas: esame del sangue potrebbe individarlo prima che diventi mortale
Gli scienziati hanno anche scoperto che KLF5 regola almeno altri due geni, NCAPD2 e MTHFD1, nelle cellule tumorali pancreatiche metastatiche, ma non in quelle primarie, coltivate in laboratorio. I due geni sono noti come geni modificatori epigenetici, che attivano o disattivano i geni non attraverso il codice genetico, ma aggiungendo gruppi chimici al DNA e contribuendo a modificarne l’impacchettamento.
Spiegano gli autori:
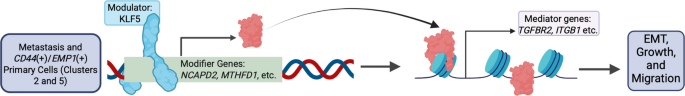
“In precedenza, abbiamo segnalato una perdita diffusa di eterocromatina con attivazione di geni pro-metastatici nel sottoinsieme di cellule di tumori pancreatici primari che hanno dato origine a metastasi epatiche e polmonari. Qui abbiamo ipotizzato che questa alterazione della cromatina potesse creare vulnerabilità uniche nelle metastasi a distanza. Utilizzando uno screening CRISPR di xenotrapianti derivati da pazienti umani da metastasi e tumori primari, abbiamo identificato KLF5 come essenziale per la proliferazione delle cellule metastatiche, ma non per la crescita del tumore primario. Inoltre, abbiamo scoperto che KLF5 induceva geni modificatori epigenetici, tra cui NCAPD2 e MTHFD1 , che a loro volta facilitavano l’espressione di geni specifici che guidano la migrazione e la transizione epitelio-mesenchimale, tra cui TGFBR2 , VIM , EMP1 e ITGB1 . L’inibizione dell’espressione di questi geni modificatori ha ripristinato l’eterocromatina nelle regioni specifiche che distinguono i tumori primari da quelli metastatici. Abbiamo supportato questa catena causale di prove con rigorosi esperimenti aggiuntivi di knockdown con i geni modificatori ed esperimenti su RNA e cromatina a singola cellula, e abbiamo anche replicato i risultati principali in una seconda serie di linee di xenotrapianto primarie e metastatiche a distanza accoppiate. Infine, l’espressione di KLF5 è risultata fortemente associata alla sopravvivenza del paziente e alla plasticità delle cellule PDAC umane in un set di dati di 70 pazienti con PDAC e l’espressione di KLF5 è risultata aumentata nella maggior parte delle metastasi polmonari, epatiche e peritoneali rispetto al tumore primario corrispondente, confermando la sua importanza nelle metastasi e nella mortalità del PDAC. In sintesi, abbiamo identificato una cascata di modulatori, modificatori e mediatori epigenetici che mantiene la diffusa perdita di eterocromatina a supporto della proliferazione delle cellule metastatiche nel cancro pancreatico umano (vedi Abstract grafico)“.
Abstract grafico
KLF5 modula le modifiche epigenetiche che guidano la proliferazione metastatica e la plasticità del PDAC
“Stiamo aggiungendo prove che le metastasi del cancro non sono causate da mutazioni aggiuntive nel cancro primario, ma da ulteriori cambiamenti epigenetici, che consentono al cancro di prosperare e crescere”, afferma il primo autore Kenna Sherman, uno studente laureato nel programma di genetica e genomica umana della Johns Hopkins.“Sembra che KLF5 sia un gene maestro che determina tali cambiamenti e influenza un percorso di geni noti per controllare l’invasione e la capacità di resistere ai trattamenti“.
Fonte: Molecular Cancer