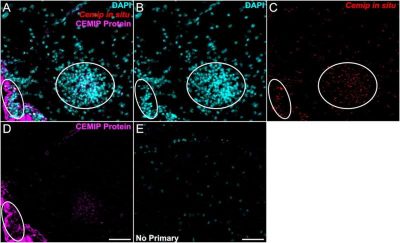
Malattie neurodegenerative-immagine: l‘immunocolorazione con un anticorpo CEMIP (viola) e l’ibridazione in situ con una sonda CEMIP (utilizzando RNAScope; rosso) rivelano la co-localizzazione di entrambi i segnali in sezioni di midollo spinale lombare di topi con EAE a 15 giorni dall’inoculazione. Barra della scala = 50 µm. I nuclei sono stati colorati con DAPI (blu). I cerchi evidenziano aree di aumentata cellularità, coerenti con la presenza di cellule immunitarie periferiche tipicamente osservate durante la progressione dell’EAE. Crediti: ASN Neuro
Ricercatori dell’Oregon Health & Science University hanno identificato un tipo di enzima dal nome complesso. La proteina legante l’acido ialuronico e inducente la migrazione cellulare (CEMIP) è associata a disturbi che vanno dalla sclerosi multipla all’ictus, fino a patologie neurodegenerative come il morbo di Alzheimer.
Il passo successivo è sviluppare un modo per colpire l’enzima e curare o rallentare la progressione della malattia.
Come il CEMIP influenza la mielina e le malattie
In uno studio pubblicato sulla rivista ASN Neuro, i ricercatori descrivono il loro percorso per identificare il CEMIP in colture cellulari, topi e tessuti umani deceduti. I ricercatori hanno scoperto che questo specifico enzima è fondamentale nelle condizioni che comportano la rottura della mielina, la guaina protettiva che ricopre l’assone di ogni cellula nervosa, la porzione filamentosa di una cellula che trasmette i segnali elettrici tra le cellule. La mielina aumenta la velocità degli impulsi nervosi.
I danni alla mielina sono associati alla sclerosi multipla, all’ictus, alle lesioni cerebrali e ad alcune forme di demenza, tra cui l’Alzheimer.
Il CEMIP scompone una molecola chiamata acido ialuronico, che si accumula nel cervello dopo un danno. Quando si accumula troppo acido ialuronico, il CEMIP forma piccoli frammenti di acido ialuronico che impediscono la riparazione del sistema nervoso.
“Se riuscissimo a regolare questo enzima, potremmo riuscire a promuovere la riparazione del sistema nervoso centrale”, ha affermato l’autore senior Larry Sherman, Ph.D., Professore presso la Divisione di Neuroscienze dell’Oregon National Primate Research Center dell’OHSU. “Ci dà un’idea più precisa di quali molecole vale la pena di colpire se vogliamo promuovere la riparazione della mielina. Questo sarà importante per la sclerosi multipla, ma potrebbe essere utile anche per l’Alzheimer e probabilmente per molte altre condizioni come l’ictus o il trauma cranico in cui la mielina viene danneggiata”.
Potenziale per il target CEMIP nel trattamento
I ricercatori avevano già stabilito il ruolo del CEMIP nella produzione di molecole infiammatorie in grado di favorire la sopravvivenza e la progressione delle cellule tumorali verso la formazione di tumori cerebrali.
Grazie a precedenti ricerche condotte presso l’OHSU, gli scienziati hanno già a disposizione un possibile strumento per contrastare il CEMIP: una ricerca pubblicata un anno fa ha identificato un composto naturale derivato dalle dalie che inibisce il CEMIP.
La nuova ricerca conferma che è probabile che il CEMIP sia l’obiettivo giusto.
I ricercatori hanno scoperto che l’enzima è elevato nelle lesioni cerebrali in cui la mielina è danneggiata nei topi e nelle persone con sclerosi multipla che avevano donato il loro corpo alla scienza. Studi su colture cellulari e sui topi hanno dimostrato che l’enzima blocca la capacità dell’organismo di rigenerare la mielina danneggiata inibendo la maturazione delle cellule progenitrici degli oligodendrociti che, a loro volta, producono oligodendrociti che generano mielina.
Leggi anche: Analoghi della vitamina K promettenti per invertire le malattie neurodegenerative
Comprendere il ruolo evolutivo del CEMIP
“Da una prospettiva evolutiva“, ha affermato Sherman, “è probabile che CEMIP svolga un ruolo nella regolazione delle risposte del cervello alle lesioni. Probabilmente è importante per la fase iniziale della risposta alle lesioni, ma il problema si verifica quando la condizione si evolve in cronica. CEMIP è efficace nel digerire l’acido ialuronico che si accumula nel nostro corpo con l’invecchiamento, ma ha anche l’effetto collaterale di inibire la capacità dell’organismo di rigenerare la mielina“.
Spiegano gli autori:
“La sclerosi multipla (SM) è caratterizzata da demielinizzazione neuroinfiammatoria del sistema nervoso centrale (SNC) che compromette la funzione motoria, sensoriale e cognitiva. Le terapie attualmente approvate per la SM prendono di mira il sistema immunitario per ridurre il numero di attacchi neuroinfiammatori, tuttavia la demielinizzazione si verifica ancora e quasi tutti i pazienti sperimentano una progressione della malattia. Le lesioni del SNC nella SM e in altre malattie demielinizzanti presentano un ritardo o un fallimento della rimielinizzazione nonostante la presenza di assoni intatti. Il fallimento della rimielinizzazione è legato, almeno in parte, all’incapacità delle cellule progenitrici degli oligodendrociti (OPC) nei siti delle lesioni di maturare in oligodendrociti mielinizzanti. È quindi probabile che i cambiamenti nei microambienti delle lesioni demielinizzanti siano la causa sottostante del blocco della maturazione delle OPC e del fallimento della rimielinizzazione. Uno di questi cambiamenti nelle lesioni demielinizzanti è l’accumulo di glicosaminoglicano ialuronato extracellulare (HA; chiamato anche acido ialuronico). L’HA è composto da unità ripetute non ramificate e non solfatate di acido glucuronico e N -acetilglucosamina di dimensioni variabili da ≤2,5×10 5. Sono stati identificati diversi recettori dell’HA che regolano la crescita, la migrazione e la differenziazione cellulare in risposta all’HA, tra cui la glicoproteina transmembrana CD44. L’aumentata sintesi di HMW HA associata all’attività ialuronidasica nelle lesioni demielinizzanti produce frammenti bioattivi di HA che compromettono la differenziazione e la rimielinizzazione delle OPC. Il blocco dell’attività dell’ialuronidasi mediante inibitori di piccole molecole promuove la maturazione dell’OPC e promuove la rimielinizzazione funzionale in un modello murino di demielinizzazione focale, dimostrando un potenziale metodo per promuovere la rimielinizzazione nella SM e in altre lesioni demielinizzanti. Tuttavia, i meccanismi dell’aumento della sintesi di HA e quali ialuronidasi siano elevate durante la demielinizzazione neuroinfiammatoria che produce frammenti di HA inibitori, sono sconosciuti. In questo studio, abbiamo cercato di identificare come l’espressione delle ialuronidasi sintasi, CD44 e diverse ialuronidasi cambi nei tessuti del SNC durante il corso della demielinizzazione neuroinfiammatoria, e di determinare se una specifica ialuronidasi sia responsabile del blocco della maturazione e della rimielinizzazione delle OPC nelle lesioni demielinizzanti. Tra le ialuronidasi, abbiamo riscontrato che il maggiore aumento di espressione nelle lesioni demielinizzanti era dovuto alla proteina che induce la migrazione cellulare e lega l’ialuronano (CEMIP; originariamente chiamata KIAA1199). La CEMIP è in grado di digerire l’HA, sebbene il meccanismo non sia chiaro. Le mutazioni in CEMIP portano a deficit uditivi e i topi privi di CEMIP mostrano deficit di memoria e apprendimento, nonché livelli aumentati di HA nel cervello. Il CEMIP svolge anche un ruolo nella progressione e nelle metastasi, anche al cervello, di un numero crescente di tumori e uno studio ha riportato che il CEMIP è elevato nelle lesioni della SM. Abbiamo scoperto che CEMIP è espresso dalle OPC nelle lesioni demielinizzanti e che digerisce l’HA ad alto peso molecolare (HMW) in frammenti bioattivi di HA che inibiscono la maturazione delle OPC. Inoltre, abbiamo scoperto che l’HA digerito da CEMIP blocca la rimielinizzazione. Questi dati supportano l’idea che CEMIP sia un potenziale bersaglio per terapie che promuovono la rimielinizzazione”.
Oltre a Sherman, tra gli autori figurano Alex Peters, BS, Kanon Yasuhara, Weiping Su, Ph.D., Steven Matsumoto, Ph.D., Peter Pham, Fatima Banine, Eliana Harris e Stephen A. Back, MD, Ph.D.
Fonte: ASN Neuro