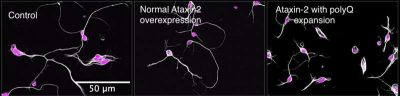
SLA- immagine: neuroni di Drosophila in coltura cellulare. Nuclei neuronali rosa, microtubuli bianchi. Si noti che i neuroni che esprimono Atassina-2 con espansione poliglutammica hanno neuriti molto più corti. Crediti: Laboratorio Gelfand
Uno studio della Northwestern Medicine ha rivelato un meccanismo chiave alla base dello sviluppo delle malattie dei motoneuroni, offrendo nuove prospettive sulle potenziali opzioni terapeutiche, secondo uno studio pubblicato sul Journal of Neuroscience.
I ricercatori hanno scoperto che una mutazione genetica nella proteina legante l’RNA Ataxin-2 (ATXN2) compromette la stabilità dei microtubuli, componenti centrali del citoscheletro dei motoneuroni, compromettendone la crescita e la funzionalità. I risultati potrebbero contribuire a definire il trattamento della sclerosi laterale amiotrofica (SLA), una malattia che distrugge progressivamente i motoneuroni e porta a debolezza muscolare e paralisi.
Lo studio, condotto su una popolazione mista di moscerini della frutta, fa luce su come l‘espansione delle ripetizioni poliglutammiche (polyQ) di ATXN2 contribuisce al rischio di SLA. La SLA è stata a lungo associata a un’errata localizzazione e aggregazione proteica. Sebbene ATXN2 sia noto come un rischio genetico, il preciso meccanismo biologico è rimasto finora sconosciuto.
“Abbiamo deciso di modellare l’espansione polyQ nei moscerini della frutta perché ci vuole molto meno tempo per studiare i cambiamenti genetici rispetto ai mammiferi“, ha affermato Vladimir Gelfand, Ph.D., Professore di scienze cellulari, molecolari e anatomiche Leslie B. Arey e autore principale dello studio.
Osservando i neuroni nei moscerini della frutta con e senza ATXN2, il team di ricerca ha scoperto che il gene regola la dinamica dei microtubuli attraverso il suo dominio di legame all’RNA. Quando le cellule sono state trattate con la versione umana di questo dominio, gli scienziati sono stati in grado di ripristinare il normale comportamento dei microtubuli nei moscerini della frutta, suggerendo che questa funzione è simile in tutte le specie.
Si è scoperto che ATXN2 ripetizioni polyQ espanse, forma aggregati citoplasmatici tossici che destabilizzano i microtubuli e compromettono pesantemente la crescita degli assoni, processi chiave nello sviluppo sano dei neuroni trasportati.
Leggi anche: La SLA sembra essere una malattia autoimmune
In assenza di una cura efficace per la SLA, queste scoperte rappresentano un passo avanti verso la comprensione della malattia a livello cellulare e verso lo sviluppo di interventi potenzialmente mirati alle cause profonde della degenerazione dei motoneuroni.
Astratto
“La sclerosi laterale amiotrofica (SLA) è una malattia neurodegenerativa fatale caratterizzata da dislocalizzazione e aggregazione di proteine nei motoneuroni. L’atassina-2 (ATXN2), una proteina legante l’RNA che ospita 22 ripetizioni di poliglutammina (polyQ), è un fattore di rischio per la SLA, quando le sue ripetizioni di polyQ si espandono a 27-33 ripetizioni. Tuttavia, la funzione fisiologica di ATXN2, al di là del suo ruolo nella regolazione dell’RNA, e il modo in cui l’espansione di polyQ in ATXN2 aumenta il rischio di SLA rimangono poco chiari. Abbiamo precedentemente dimostrato che Atx2 di Drosophila funziona come regolatore della dinamica dei microtubuli (MT) nei motoneuroni. In questo articolo, scopriamo il meccanismo molecolare alla base della regolazione di MT mediata da Atx2 e come l’espansione di polyQ ne interrompa la funzione, utilizzando una popolazione mista di Drosophila come sistema modello. Nello specifico, dimostriamo che Atx2 necessita del suo dominio Lsm di legame all’RNA per regolare i MT. In particolare, i domini LSM di ATXN2 umano ripristinano il fenotipo MT in Drosophila, dimostrando un ruolo evolutivamente conservato di ATXN2 nella regolazione di MT. È importante notare che ATXN2 espanso con polyQ forma aggregati citoplasmatici e porta a un’eccessiva destabilizzazione di MT. Inoltre, l’espansione di polyQ compromette gravemente la crescita assonale. Infine, identifichiamo uncoordinated-76 (UNC-76/FEZ1) come un effettore a valle di Atx2 nella regolazione di MT e nello sviluppo neuronale”.
“Gli scienziati non sanno ancora perché l’espansione di polyQ causa neurodegenerazione, e questo studio dimostra essenzialmente che l’effetto sui microtubuli è uno dei cambiamenti chiave”, ha affermato Gelfand. “Siamo ancora lontani dal poterlo sperimentare in clinica, ma ci fornisce una direzione per il futuro”.
Fonte: The Journal of Neuroscience