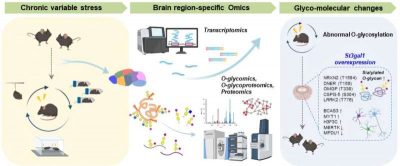
Depressione-immagine: un modello murino che mostrava comportamenti simili alla depressione è stato creato esponendo gli animali a stress cronico variabile (a sinistra). È stato quindi applicato un approccio multi-omico, utilizzando la spettrometria di massa ad alta risoluzione per analizzare la composizione degli O-glicani e le alterazioni proteiche in nove distinte regioni cerebrali (al centro). Questa analisi ha rivelato una marcata riduzione della sialilazione e della downregulation della glicosiltransferasi St3gal1 nella corteccia prefrontale, insieme a cambiamenti associati nelle proteine sinaptiche e nella funzione neuronale inibitoria (a destra). Attraverso questa strategia integrata, lo studio ha dimostrato un legame diretto tra anomalie della O-glicosilazione cerebrale e comportamenti simili alla depressione. Crediti: Institute for Basic Science.
Piccoli zuccheri nel cervello interrompono i circuiti emotivi, alimentando la depressione.
La depressione è un disturbo grave che sconvolge la vita quotidiana causando letargia, disturbi del sonno e isolamento sociale, e aumenta anche il rischio di suicidio. Il numero di pazienti affetti da depressione è aumentato costantemente nel corso degli anni, colpendo oltre 280 milioni di persone in tutto il mondo nel 2025. Ora, i ricercatori hanno scoperto un nuovo meccanismo patologico che potrebbe fornire indizi per la diagnosi e il trattamento della depressione.
Un team di ricerca guidato da C. Justin Lee e Lee Boyoung presso l’Institute for Basic Science (IBS) ha identificato un nuovo percorso molecolare nel cervello che collega direttamente alterazioni anomale degli zuccheri nelle proteine ai comportamenti depressivi. Nello specifico, lo stress cronico interrompe le catene di zuccheri (O-glicani) legate alle proteine nella corteccia prefrontale, innescando così la depressione.
I risultati, pubblicati su Science Advances, aprono nuove possibilità per terapie mirate contro la depressione resistente al trattamento.
La depressione deriva da una complessa interazione di fattori psicologici, ambientali e genetici e sono stati segnalati molti meccanismi patologici diversi. Tuttavia, la maggior parte dei farmaci antidepressivi in uso clinico si concentra sulla regolazione dei neurotrasmettitori, in particolare della serotonina.
Questi farmaci, tuttavia, sono efficaci solo per circa la metà dei pazienti e spesso causano effetti collaterali come problemi gastrointestinali o peggioramento dell’ansia. Questa limitazione sottolinea la necessità di ricercare nuovi percorsi molecolari nel cervello , oltre alla segnalazione dei neurotrasmettitori.
I ricercatori si sono concentrati sulla glicosilazione, il processo mediante il quale piccole catene di zuccheri si legano alle proteine, alterandone la struttura e la funzione. La glicosilazione è stata riconosciuta come un meccanismo importante in varie patologie, tra cui cancro, infezioni virali e disturbi neurodegenerativi. Tra le sue forme, l’O-glicosilazione svolge un ruolo nella segnalazione cellulare e nel mantenimento dell’equilibrio nei circuiti neurali, sebbene il suo coinvolgimento nei disturbi cerebrali abbia iniziato a essere studiato solo di recente.
Utilizzando la spettrometria di massa ad alte prestazioni, il team ha prima analizzato i modelli di O-glicosilazione in nove regioni cerebrali di topi sani e ha scoperto che ciascuna regione presentava caratteristiche di glicosilazione distinte. Hanno poi confrontato questi dati con quelli dei cervelli di topi sottoposti a stress cronico, rivelando alterazioni significative nella O-glicosilazione in regioni come la corteccia prefrontale.
In particolare, hanno osservato una riduzione della sialilazione (l’aggiunta di acido sialico alle estremità delle catene di zucchero, che stabilizza le proteine), insieme a una diminuzione dell’espressione dell’enzima St3gal1, che media questa modifica.
Per verificare se questo enzima sia direttamente collegato al comportamento depressivo, i ricercatori hanno manipolato l’espressione di St3gal1 nella corteccia prefrontale di topi normali e stressati. La soppressione di St3gal1 nei topi normali ha causato la comparsa di sintomi simil-depressivi – perdita di motivazione, ansia elevata – anche in assenza di stress. Al contrario, l’aumento di St3gal1 nei topi stressati ha alleviato i loro comportamenti depressivi. Questi risultati identificano la riduzione di St3gal1 come un fattore molecolare chiave che induce e regola direttamente i sintomi depressivi.
Ulteriori analisi proteiche ed esperimenti elettrofisiologici hanno dimostrato che la riduzione di St3gal1 destabilizzava le strutture delle catene zuccherine delle molecole sinaptiche, inclusa la neurexina 2 (NRXN2), una proteina di adesione sinaptica, e comprometteva la funzione dei neuroni inibitori che normalmente contribuiscono a mantenere l’equilibrio nei circuiti cerebrali.
“In altre parole, piccole alterazioni nelle catene zuccherine interrompevano simultaneamente sia le connessioni che la stabilità dei circuiti neurali, provocando infine il collasso del sistema di regolazione delle emozioni del cervello”, spiegano gli autori.
Legggi anche:Depressione: identificate per la prima volta le cellule cerebrali responsabili
“Questo studio dimostra che una glicosilazione anomala nel cervello è direttamente collegata all’insorgenza della depressione”, ha affermato il ricercatore Boyoung Lee. “Fornisce un importante punto di partenza per l’identificazione di nuovi marcatori diagnostici e bersagli terapeutici oltre ai neurotrasmettitori”.
“La depressione rappresenta un grave onere sociale, eppure i trattamenti attuali rimangono limitati“, ha aggiunto il Direttore C. Justin Lee. “Questo risultato potrebbe estendersi non solo alla terapia della depressione, ma anche ad altre malattie mentali come il disturbo da stress post-traumatico e la schizofrenia, aprendo la strada a strategie terapeutiche più ampie“.
Fonte: Science Advances