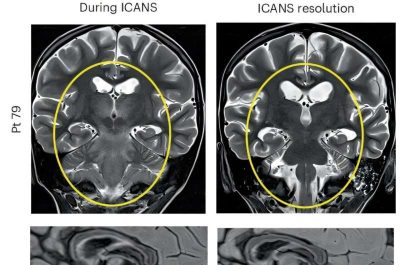
Neuroblastoma-immagine:tossicità GD2–CART01. Evidenze RM delle alterazioni T2/FLAIR osservate in due pazienti che hanno sviluppato ICANS di grado 3 (in alto a sinistra e in basso a sinistra) e la loro completa risoluzione (in alto a destra e in basso a destra). Credito: Nature Medicine.
Dall’Ospedale Pediatrico Bambino Gesù di Roma arriva un rapporto secondo cui una terapia con cellule CAR T di terza generazione che prende di mira GD2, denominata GD2–CART01, ha indotto remissioni durature e sopravvivenza a lungo termine nei bambini con neuroblastoma metastatico, recidivante o refrattario ad alto rischio.
Il neuroblastoma ad alto rischio spesso comporta scarsi risultati a lungo termine dopo il fallimento della prima linea, con studi precedenti che hanno evidenziato una sopravvivenza libera da progressione e una sopravvivenza complessiva ampiamente inferiori al 20%.
I recenti risultati dello studio randomizzato BEACON-Neuroblastoma della Society of Pediatric Oncology European Neuroblastoma Group hanno riportato risultati migliori rispetto ai controlli storici, ma il tasso di risposta complessivo non ha superato il 30% ed è stato osservato un alto tasso di successiva progressione e recidiva.
I dati dello studio ANBL1221 del Children’s Oncology Group e le successive analisi nordamericane ed europee hanno riportato un tasso di risposta globale del 41,5% e una sopravvivenza libera dalla progressione a un anno del 67,9% per la chemioimmunoterapia con anticorpi monoclonali diretti contro GD2 in associazione alla chemioterapia. Tra i 21 pazienti che hanno interrotto la terapia, la successiva sopravvivenza ha liberato la progressione a un anno è stata del 26%.
Nello studio “GD2-targeting CAR T cells in high-risk neuroblastoma: a phase 1/2 trial”, pubblicato su Nature Medicine, i ricercatori hanno condotto uno studio clinico di fase I/IIa monocentrico per valutare la sicurezza, la dose massima tollerata, il tasso di risposta complessivo e la remissione completa a sei settimane, tre mesi e sei mesi, con endpoint secondari tra cui la sopravvivenza complessiva a cinque anni e la persistenza di GD2–CART01.
Una fase di determinazione della dose ha testato concentrazioni multiple utilizzando un disegno di studio di escalation-de-escalation, seguita da una fase di Fase II che ha trattato tutti i partecipanti con il farmaco con le migliori prestazioni. Gli obiettivi primari includevano la sicurezza, l’identificazione della dose massima tollerata , il tasso di risposta globale e il dosaggio che ha raggiunto la remissione completa a sei settimane, tre mesi e sei mesi. Gli obiettivi secondari includevano la sopravvivenza globale a cinque anni e la persistenza di GD2-CART01.
Tra i 32 bambini valutabili nello studio, la risposta complessiva ha raggiunto il 66% (21/32). La remissione completa ha raggiunto il 37% a sei settimane, il 34% a tre mesi e il 40% a sei mesi. GD2–CART01 è persistita per almeno 12 mesi nel 64% dei partecipanti allo studio valutabili a un follow-up più lungo.
Con un follow-up mediano di 4,2 anni, la sopravvivenza complessiva a cinque anni per la coorte dello studio ha raggiunto il 42,67%.
Nella popolazione target predefinita con basso carico di malattia, la risposta complessiva ha raggiunto il 77%. La sopravvivenza complessiva a cinque anni ha raggiunto il 67,6% e la sopravvivenza libera da eventi ha raggiunto il 52,8%.
Spiegano gli autori:
“Le cellule T antidisialoganglioside (GD2), recettori chimerici antigenici (CAR) di terza generazione (GD2–CART01), hanno mostrato un’efficacia incoraggiante nei bambini con neuroblastoma metastatico, recidivante o refrattario ad alto rischio nell’analisi ad interim di uno studio clinico di fase 1/2. Presentiamo ora i risultati finali ottenuti in tutti i 35 pazienti arruolati e in altri 19 bambini selezionati con gli stessi criteri dello studio e trattati in regime di esenzione ospedaliera. Gli endpoint primari dello studio erano la sicurezza, la dose massima tollerata, il tasso di risposta globale (ORR) e il tasso di remissione completa a vari tempi. Gli endpoint secondari includevano la sopravvivenza globale (OS) a 5 anni e la persistenza di GD2–CART01. Non sono stati osservati nuovi segnali di sicurezza. La sindrome da neurotossicità associata alle cellule effettrici immunitarie di grado 3 è stata diagnosticata in quattro bambini ed è stata rapidamente controllata con l’attivazione del gene suicida della caspasi-9 inducibile mediante rimiducid. La dose massima tollerata è stata di 10 × 10 6 cellule CAR + per kg. L’ORR dei pazienti arruolati nello studio clinico è stato del 66% (21/32, esclusi i tre pazienti trattati in assenza di evidenza di malattia). Il tasso di remissione completa a 6 settimane, 3 mesi e 6 mesi ha raggiunto rispettivamente il 37%, il 34% e il 40%”.
Sono stati osservati tassi di sopravvivenza complessiva e libera da eventi a cinque anni migliori nei bambini trattati dopo una o due linee di terapia precedenti rispetto a quelli trattati dopo tre o più linee.
La sindrome da rilascio di citochine, una reazione infiammatoria, si è verificata nel 79,6% dei bambini trattati, per lo più di prima e seconda elementare, con quattro eventi di terza media.
Leggi anche:Neuroblastoma: nuovo studio spiega perché ritorna anni dopo
La sindrome da neurotossicità associata alle cellule effettrici immunitarie, un grave deterioramento neurologico e cognitivo, si è verificata in 10 bambini, ha raggiunto il terzo anno di scuola in quattro ed è stata controllata attivando rapidamente “l’interruttore di sicurezza”, un gene suicida inducibile della caspasi-9 ingegnerizzato nelle cellule GD2–CART01 infuse. L’attivazione si è verificata dopo la somministrazione di Rimiducide, con un rapido calo delle cellule CAR T circolanti e un miglioramento clinico segnalato.
Gli autori concludono che GD2–CART01 può indurre remissioni durature nei bambini con neuroblastoma ad alto rischio, soprattutto se somministrato a basso carico di malattia e in una fase precoce del ciclo di trattamento. I prossimi passi includono uno studio clinico multicentrico internazionale di Fase II.
Fonte:Nature Medicine