I ricercatori in Germania hanno scoperto un recettore nascosto, il GPR133, che svolge un ruolo fondamentale nella resistenza delle ossa.
Attivandolo con un nuovo composto chiamato AP503, hanno aumentato la densità ossea nei topi e hanno persino invertito i sintomi simili all’osteoporosi.
Crescente necessità di trattamenti per l’osteoporosi
C’è una forte richiesta di farmaci in grado di prevenire in modo sicuro ed efficace la perdita ossea a lungo termine. L’osteoporosi, il termine medico per questa condizione, colpisce circa sei milioni di persone in Germania, la maggior parte delle quali donne. Per sviluppare trattamenti migliori con minori effetti collaterali, gli scienziati stanno lavorando all’identificazione di nuovi bersagli biologici. Un candidato promettente è il recettore accoppiato alla proteina G di adesione GPR133, che appartiene a una famiglia di recettori in gran parte inesplorata. In una recente ricerca, i ricercatori dell’Università di Lipsia hanno dimostrato che GPR133 è essenziale per la formazione e il mantenimento di ossa forti.
“Se questo recettore è compromesso da alterazioni genetiche, i topi mostrano segni di perdita di densità ossea in giovane età, simili all’osteoporosi negli esseri umani. Utilizzando la sostanza AP503, che solo di recente è stata identificata tramite uno screening computerizzato come stimolatore di GPR133, siamo stati in grado di aumentare significativamente la resistenza ossea sia nei topi sani che in quelli osteoporotici“, spiega la Prof.ssa Ines Liebscher, ricercatrice principale dello studio presso l’Istituto di Biochimica Rudolf Schönheimer della Facoltà di Medicina.
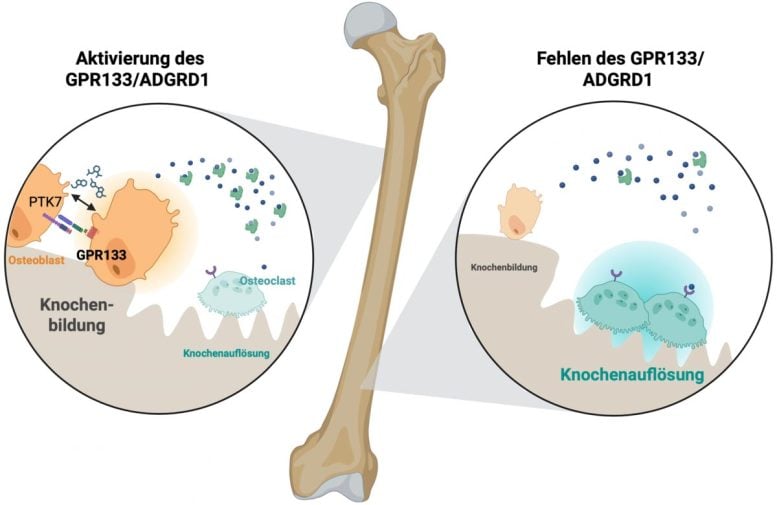
Come funzionano i segnali di rafforzamento osseo
All’interno del tessuto osseo, GPR133 viene attivato sia dalle interazioni tra cellule ossee adiacenti sia dalle sollecitazioni meccaniche. Questa attivazione genera un segnale che aumenta l’attività delle cellule che costruiscono le ossa (osteoblasti), inibendo al contempo le cellule che le distruggono (osteoclasti). Il risultato: ossa più forti e resistenti. AP503 ha la capacità di replicare questo processo di segnalazione naturale. In futuro, potrebbe essere utilizzato per migliorare la salute delle ossa in individui sani e per ricostruire l’osso in coloro che soffrono di osteoporosi, in particolare nelle donne dopo la menopausa.