Cancro del pancreas-immagine:astratto grafico credito Developmental Cell.
Gli scienziati hanno scoperto un comportamento simile alla demenza nelle cellule del pancreas a rischio di trasformarsi in cancro. I risultati forniscono indizi che potrebbero aiutare nel trattamento e nella prevenzione del cancro al pancreas, una malattia difficile da curare che causa 6.900 decessi ogni anno nel Regno Unito.
La ricerca è stata pubblicata sulla rivista Developmental Cell in un articolo intitolato “ER-phagy and proteostasis defects prime pancreatic epithelial state changes in KRAS-mediated oncogenesis”.
I ricercatori del Cancer Research UK Scotland Center hanno studiato le cellule pancreatiche nei topi nel corso del tempo, per capire cosa causasse la trasformazione delle cellule sane in cellule tumorali. Hanno scoperto che le cellule pancreatiche a rischio di diventare cancerose, note come cellule precancerose, sviluppano difetti nel processo di riciclo cellulare (noto come “autofagia”).
Nelle cellule precancerose, i ricercatori hanno notato un eccesso di molecole di “proteine problematiche” che formavano aggregati, un comportamento osservato in malattie neurologiche come la demenza. I ricercatori hanno anche notato un’aggregazione simile in campioni di pancreas umano, suggerendo che ciò si verifichi durante lo sviluppo del cancro al pancreas.
Il Professor Simon Wilkinson, ricercatore senior del Cancer Research UK presso l’Istituto di Genetica e Cancro dell’Università di Edimburgo, ha affermato: “La nostra ricerca dimostra il potenziale ruolo dell’interruzione dell’autofagia nelle fasi iniziali del cancro al pancreas. Sebbene si tratti di una fase iniziale, possiamo potenzialmente imparare dalla ricerca su altre malattie in cui osserviamo l’aggregazione proteica, come la demenza, per comprendere meglio questo tipo aggressivo di cancro e come prevenirlo“.
Sebbene la sopravvivenza per molti tipi di cancro sia migliorata negli ultimi decenni, lo stesso non è stato per il cancro al pancreas. Questo è in parte dovuto al fatto che spesso viene diagnosticato in una fase avanzata, quando le opzioni terapeutiche sono limitate. Per affrontare questo problema, i ricercatori hanno voluto approfondire le possibili cause della trasformazione delle cellule del pancreas in cancro.
Molti tipi di cancro, tra cui il cancro al pancreas, sono collegati a una mutazione difettosa in un gene chiamato KRAS, ma gli scienziati stanno scoprendo sempre più che i cambiamenti genetici non sono tutto.
Uno dei modi in cui le cellule mantengono le persone sane è scomponendo le molecole in eccesso di cui non hanno più bisogno, attraverso un processo di riciclo chiamato “autofagia”. L’autofagia è particolarmente importante nel pancreas per controllare il livello di proteine digestive e ormoni che il pancreas produce per aiutare a scomporre il cibo.
Gli scienziati hanno studiato l’autofagia in dettaglio per molti anni e stanno scoprendo il ruolo chiave che svolge in malattie come il cancro. In alcuni casi, le cellule tumorali possono diventare “dipendenti” dall’autofagia, dirottando il processo di riciclo per dividersi e crescere più rapidamente.
Questa ricerca, d’altra parte, suggerisce che l’effetto combinato del gene KRAS difettoso e dell’autofagia alterata potrebbe essere alla base dello sviluppo del cancro al pancreas. I ricercatori intendono studiare questi processi più in dettaglio, per verificare se possano aiutare a predire o eventualmente invertire l’insorgenza del cancro al pancreas e se fattori come età, sesso o dieta giochino un ruolo.
Leggi anche:Cancro del pancreas: nuova scoperta nel campo del trattamento
Sspiegano gli autori :
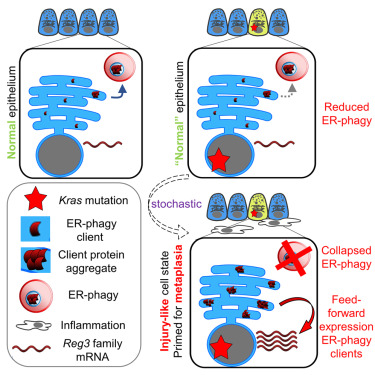
“Le mutazioni oncogeniche possono essere tollerate indefinitamente dalle cellule epiteliali di alcuni tessuti, senza apparenti conseguenze fenotipiche. Tali cellule presentano una bassa probabilità di trasformazione in stati precursori del cancro. Si presume che ulteriori eventi stocastici cooperino con la mutazione dell’oncogene per facilitare l’inizio del cancro. L’identificazione di questi eventi è un passaggio necessario per l’assemblaggio di una descrizione meccanicistica molecolare del rischio di cancro. La loro scoperta migliorerebbe lo sviluppo di strategie preventive. L’adenocarcinoma duttale pancreatico (PDAC) esemplifica questo concetto. Il PDAC ha origine nell’epitelio pancreatico esocrino, da cellule acinose o duttali. In circa il 90% dei casi, ciò si verifica dopo la mutazione iniziale dell’oncogene KRAS . Tuttavia, i modelli murini mostrano che le cellule acinose possono ospitare l’ oncogene Kras molto prima dei cambiamenti dello stato morfologico, dell’iperproliferazione manifesta o di altre risposte canoniche come la senescenza. Un danno imposto dall’esterno innesca nelle cellule acinose un cambiamento di stato reversibile denominato metaplasia acino-duttale (ADM). Nei modelli murini, il Kras oncogenico riduce la risoluzione dell’ADM indotta dal danno, determinando stati cellulari pseudo-duttali persistenti che seminano lesioni duttali pre-maligne (neoplasia intraepiteliale pancreatica [PanIN]). Inoltre, la risoluzione di un danno sperimentale storico predispone le cellule acinose di tipo selvatico all’ADM in caso di futura mutazione del Kras. Tali modelli di danno riflettono il ruolo della pancreatite cronica, che prefigura una minoranza di PDAC umani, come evento cooperante nell’ADM e nella PanIN indotte da oncogeni. Tuttavia, nella maggior parte dei casi di PDAC che non sono preceduti da un danno manifesto, gli eventi cooperanti stocastici rimangono sconosciuti. In effetti, solo una piccola minoranza di cellule acinose portatrici di Kras oncogenico subirà spontaneamente un ADM irreversibile in assenza di lesioni imposte dall’esterno. Ciò solleva la questione dell’identità degli eventi molecolari che sostituiscono le lesioni imposte dall’esterno in cooperazione con Kras oncogenico. Un ipotetico evento cooperante potrebbe essere una compromissione sporadica dell’omeostasi delle cellule acinose, che potrebbe, a sua volta, generare stati cellulari patologici predisposti all’ADM. A questo proposito, la delezione sperimentale dei geni dell’autofagia, che compromette il catabolismo lisosomiale di massa del citoplasma, determina uno stress catastrofico del reticolo endoplasmatico (ER), infiammazione e sensibilizzazione all’ADM. Tuttavia, vi sono scarse prove che la soppressione dell’autofagia sia un evento fondamentale nel PDAC indotto da Kras; infatti, è noto che Kras oncogenico stimola l’autofagia di massa. Inoltre, il PDAC consolidato si basa sull’autofagia per la progressione. A differenza dell’autofagia di massa, l’autofagia selettiva concettualizza l’autofagia come percorsi multipli e distinti che prendono di mira diversi organelli per la degradazione. In vivo, si prevede che questi diversi percorsi mantengano l’omeostasi cellulare in modo sostanzialmente tessuto-specifico. È interessante notare che è stato stabilito un ruolo per i percorsi di autofagia selettiva nella regolazione della crescita di PanIN e PDAC, in particolare la mitofagia e la ferritinofagia. Inoltre, la proteina multifunzionale p62, che facilita molti percorsi di autofagia selettiva oltre ai percorsi di segnalazione cellulare, previene l’attivazione del soppressore tumorale p53 in risposta all’attivazione di Kras. Nonostante ciò, non è noto se l’autofagia selettiva regoli l’innesco dell’epitelio acinoso normale per l’ADM. Ciononostante, si stanno accumulando prove dell’importanza nelle cellule acinose dell’ER-fagia, la degradazione autofagica selettiva dell’ER. Meccanicisticamente, l’ER-fagia è specificata dalle proteine del “recettore del carico” nella membrana dell’ER, tra cui CCPG1 (gene 1 della progressione del ciclo cellulare), FAM134B, TEX264 e SEC62, che si legano alle proteine dell’autofagia citoplasmatica. In effetti, la perdita della funzione di Ccpg1 murina provoca l’accumulo di granuli proteici all’interno dell’ER acinoso, suggerendo un fallimento proteostatico primario o secondario. Tuttavia, la base molecolare dei difetti proteostatici rimane poco chiara, così come le loro sequele fisiologiche e se queste aberrazioni si verifichino o meno patologicamente. In questo lavoro, un reporter dell’ER-fagia dimostra un’attività basale eterogenea nell’epitelio acinoso. Tuttavia, la soppressione si verifica come risposta trascrizionale precoce alla mutazione di Kras e la sua entità è correlata spazialmente con l’emergere di ADM. L’ablazione genetica dell’ER-fagia mostra che tale soppressione ha un ruolo causale nell’evoluzione delle lesioni pre-maligne, cooperando con Kras nella generazione di microinfiammazione e ADM, PanIN e, in ultima analisi, cancro. L’analisi proteomica identifica proteine dell’ER (“clienti”) espresse tessuto-specificamente che richiedono l’ER-fagia per il turnover e il mantenimento della solubilità. Un cliente degno di nota è il marcatore di danno REG3B (regenerating islet-derived protein 3-beta), che lega fisicamente il recettore CCPG1 all’interno del lume dell’ER. Dimostriamo che la soppressione dell’ER-fagia da parte di Kras guida la formazione di aggregati proteici luminali composti da clienti dell’ER-fagia. Ciò è più evidente nelle cellule acinose morfologicamente normali prossimali all’ADM, sia nei topi che negli esseri umani, in linea con la massima inibizione dell’ER-fagia in questo caso. La trascrittomica spaziale rivela che gli aggregati indicano uno stato acinoso minoritario, indicativo di danno localizzato di basso livello e di predisposizione all’ADM. È importante sottolineare che la generazione diretta di aggregati attraverso l’espressione ectopica di REG3B insolubile mostra che questi sono sufficienti a guidare lo stato delle cellule acinose simile a un danno e l’ADM”.
Il Dott. Iain Foulkes, Direttore Esecutivo di Ricerca e Innovazione presso Cancer Research UK, ha dichiarato: “Ogni anno nel Regno Unito vengono diagnosticati circa 10.500 casi di cancro al pancreas e, purtroppo, troppi di questi casi si verificano in una fase in cui le opzioni terapeutiche sono limitate. Sebbene siano necessari ulteriori studi, questi risultati potrebbero fornire indizi essenziali su come comprendere meglio lo sviluppo del cancro al pancreas “.
Fonte:Developmental Cell