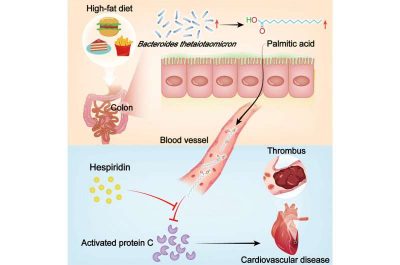
Acido palmitico-immagine: il meccanismo dell’asse dieta ricca di grassi-microbiota intestinale-acido palmitico nella trombosi. Crediti: Huang Xiaoshan
Grazie a uno sforzo collaborativo, i ricercatori hanno scoperto un nuovo legame tra l’acido palmitico (PA) derivato dal microbiota intestinale e l’aumento del rischio di trombosi nelle malattie cardiovascolari (CVD).
I loro risultati, pubblicati su Cell Reports Medicine, rivelano come una dieta ricca di grassi aumenti l’attività fisica attraverso i batteri intestinali e induca ipercoagulazione.
Un numero crescente di studi collega il microbiota intestinale alle malattie cardiovascolari. La dieta dell’ospite e i macronutrienti sono mediatori chiave che collegano le interazioni tra ospite e microbiota intestinale. L’acido palmitico (PA) circolante deriva principalmente dalla dieta e dalla sintesi endogena e un livello elevato è tipicamente correlato a un aumentato rischio di malattie cardiovascolari. Tuttavia, non è chiaro se il microbiota intestinale moduli l’PA circolante e la trombosi, il processo patologico principale nelle malattie cardiovascolari.
In questo studio, i ricercatori, tra cui il Prof. Lai Ren del Kunming Institute of Zoology dell’Accademia cinese delle scienze e il Prof. Ni Heyu dell’Università di Toronto, hanno riscontrato livelli significativamente più elevati di PA circolante e stati di ipercoagulabilità nei pazienti con malattie cardiovascolari rispetto ai controlli sani.
Inoltre, l’abbondanza relativa di BT era significativamente più elevata nel gruppo CVD, mostrando un aumento di circa 2,18 volte rispetto al gruppo di controllo sano.
Esaminando l’effetto dell’acido polilattico sulle proteine coagulanti e anticoagulanti, i ricercatori hanno scoperto che l‘acido polilattico agisce come inibitore dell’APC, un componente chiave del sistema anticoagulante fisiologico. Inoltre, l’acido polilattico promuove l’attivazione piastrinica che può successivamente influenzare la trombosi mediata dalle piastrine. La capacità procoagulante dell’acido polilattico è stata ulteriormente confermata nei modelli murini.
Hanno poi analizzato i metaboliti dei ceppi intestinali di BT e hanno scoperto che questi ceppi potevano produrre PA in vitro. I topi colonizzati con BT mostravano elevati livelli plasmatici di PA e un corrispondente stato di ipercoagulabilità, suggerendo un ruolo causale di questo microbio intestinale nella modulazione del rischio di trombosi dell’ospite.
“Le abitudini alimentari dell’ospite influenzano direttamente la composizione e la funzionalità del microbioma intestinale. In particolare, una dieta ricca di grassi ha promosso la colonizzazione del BT nell’ospite, aumentando i livelli plasmatici di PA e inducendo quindi ipercoagulazione”, spiegano gli autori.
Leggi anche:Grassi saturi e rischio di malattie cardiache: nuova comprensione
Spiegano gli autori:
“Le malattie cardiovascolari (CVD) rappresentano la principale causa di morte in tutto il mondo e sono caratterizzate da una varietà di sintomi clinici, tra cui ictus, angina, infarto del miocardio (IM) e/o morte cardiaca improvvisa. Nuove evidenze suggeriscono che le interazioni ospite-microbiota che coinvolgono percorsi infiammatori e metabolici possono contribuire allo sviluppo di fattori di rischio per le CVD e che le alterazioni del microbiota intestinale potrebbero svolgere un ruolo nelle CVD. Il microbiota intestinale sintetizza molecole come la trimetilammina N-ossido (TMAO), acidi grassi a catena corta e metaboliti degli acidi biliari che possono essere associati alle CVD. Possono causare ipercoagulazione inducendo iperattività piastrinica, dislipidemia e stress ossidativo. Secondo Violi et al., il lipopolisaccaride, un glicolipide presente sulla membrana esterna dei batteri intestinali Gram-negativi, può agire come una molecola protrombotica per promuovere la coagulazione e l’attivazione piastrinica. Data la loro significativa associazione con le malattie cardiovascolari, il microbiota intestinale e i loro metaboliti potrebbero essere importanti obiettivi per la terapia delle malattie cardiovascolari da una prospettiva clinica. La dieta dell’ospite e i macronutrienti sono mediatori chiave che collegano le interazioni tra ospite e microbiota intestinale. La dieta nutrizionale ha un impatto diretto sulla composizione e sulla funzione del microbiota intestinale, mentre il microbiota intestinale può fornire nutrienti all’ospite elaborando la dieta e sintetizzando metaboliti. Essendo uno dei tre principali nutrienti essenziali per l’uomo, i lipidi agiscono come componenti delle fonti di energia. L’intestino assorbe gli acidi grassi, una componente principale dei lipidi, che svolgono un ruolo cruciale nel modellare le interazioni ospite-microbiota. Nel nostro organismo, l’acido palmitico (PA) è l’acido grasso saturo più abbondante e si ritiene che venga fornito dalla dieta e dalla sintesi endogena. È stato riscontrato che l’PA circolante è negativamente associato al rischio di malattie cardiovascolari e mortalità per tutte le cause. Possibili meccanismi includono un aumento del colesterolo delle lipoproteine a bassa densità (LDL-C) e la sintesi di ceramidi ed esteri ramificati degli acidi grassi idrossilati (FAHFA), che sono correlati ai metaboliti del PA. Non è noto se il microbiota intestinale moduli l’acido urico circolante e se l’acido urico stesso abbia un impatto diretto sullo sviluppo delle malattie cardiovascolari”.
L’esperidina, un bioflavonoide alimentare abbondante ed economico, blocca l’interazione PA-APC, prevenendo l’ipercoagulazione indotta dal trapianto di PA o BT. Ciò rivela un nuovo meccanismo anticoagulante di questo composto alimentare.
Pertanto, l’asse dieta ricca di grassi, microbiota intestinale e acido palmitico, potrebbe rivelare un nuovo meccanismo patofisiologico associato al rischio di malattie cardiovascolari.
Fonte: Cell Reports Medicine