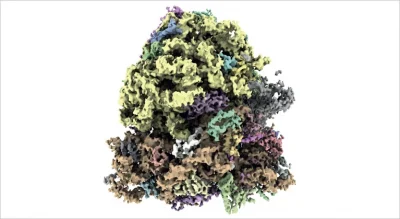
Microscopia elettronica criogenica (cryo-EM) a falsi colori che mostra la struttura molecolare del ribosoma 70S. I ribosomi svolgono un ruolo cruciale nella sintesi proteica. Crediti: Riprodotto dal Rif. 2 e concesso in licenza con licenza CC BY 4.0. © 2023 G. McMullan et al.
L’ascesa fulminea della microscopia crioelettronica, da oscura tecnica di imaging a strumento potentissimo per la determinazione delle strutture biomolecolari, sta trasformando la nostra comprensione della biologia.
La nostra conoscenza del funzionamento della biologia a livello molecolare si sta espandendo a un ritmo incredibile, con nuove strutture molecolari che vengono determinate a una velocità mai vista prima. Questa età d’oro per la biologia strutturale promette di migliorare notevolmente la nostra comprensione dei meccanismi delle malattie e di favorire lo sviluppo di nuovi farmaci e terapie.
Un fattore chiave di questo incremento di conoscenze è l’adozione della microscopia elettronica criogenica (cryo-EM). Questa potente tecnica consente di visualizzare molecole biologiche come proteine, enzimi e virus con una risoluzione atomica.
Uno dei maggiori vantaggi rispetto alla diffrazione dei raggi X per lo studio della struttura molecolare è che i campioni contenenti le molecole di interesse non devono essere cristallizzati prima dell’imaging. Vengono invece congelati e mantenuti a temperature criogeniche (solitamente -196 °C) così rapidamente che le molecole d’acqua in essi contenute non hanno la possibilità di cristallizzare in ghiaccio, il che potrebbe alterare la struttura delle biomolecole.
“Il vantaggio principale della crio-EM è la sua capacità di visualizzare le strutture molecolari essenzialmente nel loro stato nativo: permette di avvicinarsi il più possibile allo stato di un organismo vivente e funzionante”, afferma Roland Fleck, Direttore del Centre for Ultrastructural Imaging del King’s College di Londra, nel Regno Unito. “Apre un mondo di opportunità di ricerca che non si possono ottenere in nessun altro modo. E le immagini sono di una bellezza straordinaria quando tutto è perfetto”.
JEOL, produttore di strumenti scientifici e medici con sede a Tokyo, in Giappone, è stato uno dei pionieri nello sviluppo della crio-EM ed è oggi leader nel settore. L’azienda continua a collaborare con ricercatori come Fleck per incrementare ulteriormente la diffusione globale della tecnologia.
“L’innovazione e lo sviluppo di strumenti con il supporto di produttori come JEOL hanno svolto un ruolo fondamentale nel progresso della crio-EM”, afferma Fleck. “Questa partnership è stata fondamentale per i progressi scientifici in tutte le scienze della vita: JEOL ha fornito un supporto sostanziale nel corso degli anni a progetti innovativi e ad alto rischio, senza la pressione commerciale di dover fornire risultati rapidi“.
Rivoluzione della risoluzione
La crio-EM è arrivata relativamente tardi sulla scena della biologia strutturale. Per decenni, la diffrazione dei raggi X è stata la tecnica di riferimento per determinare le strutture biomolecolari. Il suo utilizzo più famoso è stato quello per scoprire la struttura del DNA nei primi anni ’50.
Negli anni ’70 si è iniziato a utilizzare la risonanza magnetica nucleare (RMN) per determinare le strutture 3D delle biomolecole.
Ma è stato solo intorno al 2012 che la crio-EM ha preso davvero piede. È stato allora che si è verificata la “rivoluzione della risoluzione” grazie allo sviluppo di rivelatori di elettroni diretti, che ora catturano le immagini all’interno dei sistemi crio-EM, migliorando notevolmente la risoluzione. In precedenza, i rivelatori convenzionali convertivano gli elettroni in luce, un processo indiretto che produceva immagini più sfocate.
Uno dei pionieri della rivoluzione della risoluzione, Richard Henderson è stato insignito del Premio Nobel per la Chimica 2017 per il suo ruolo nello sviluppo della crio-EM ad alta risoluzione. Scienziato emerito presso il Laboratorio di Biologia Molecolare del Medical Research Council di Cambridge, nel Regno Unito, ha assistito in prima persona a come questo sviluppo abbia trasformato il settore.
“Prima della rivoluzione della risoluzione, la crio-EM era un campo limitato. La gente la considerava un po’ isolata, un metodo di nicchia che non avrebbe mai avuto successo“, ricorda Henderson. “Nessuno ci concedeva finanziamenti per sviluppare rivelatori, e così abbiamo finito per formare un consorzio per finanziare il nostro lavoro”.
Nel 2013, il suo laboratorio era uno dei soli tre al mondo a disporre di un microscopio crioelettronico ad alta risoluzione. Ora ce ne sono centinaia in tutto il mondo. “Da allora, la sua diffusione è cresciuta esponenzialmente”, aggiunge.
I biologi strutturali si sono dati da fare per determinare le strutture di biomolecole che non potevano essere cristallizzate tramite diffrazione a raggi X a causa di problemi quali complessità strutturale e problemi di solubilità. Entro il 2025, il numero di nuove strutture determinate tramite crio-EM supererà presto quelle determinate tramite diffrazione a raggi X.
Un rendering digitale di proteine che si ripiegano in strutture 3D. La microscopia elettronica criogenica sta ampliando la nostra conoscenza del funzionamento dei sistemi biologici su scala molecolare. Crediti: Christoph Burgstedt/Science Photo Library/Getty
“Più grande” non sempre migliore
Per certi versi, la crio-EM è ormai vittima del suo stesso successo, poiché può essere difficile ottenere tempo per un microscopio. “Nel nostro laboratorio, bisogna prenotare con sei settimane di anticipo per ottenere un giorno di tempo per una delle nostre crio-EM”, afferma Henderson. “Al contrario, è possibile recarsi direttamente a uno dei nostri sistemi di diffrazione a raggi X e utilizzarlo immediatamente“.
Aggiunge che il Regno Unito attualmente dispone di circa 30-40 dispositivi crio-EM, ma “ne servono almeno 100” per soddisfare l’attuale domanda dei ricercatori. Tuttavia, l’accesso alla crio-EM è ostacolato dal prezzo elevato dei microscopi, che ammonta a diversi milioni di dollari ciascuno.
“I grandi macchinari che utilizzano fasci di elettroni da 300 keV costano circa 10 milioni di dollari a strumento, il che è proibitivo per molte università e istituzioni“, afferma Radostin Danev, fisico dell’Università di Tokyo.
Henderson osserva che i produttori di strumenti tendono ad aggiungere le ultime innovazioni ai loro microscopi, il che ne fa aumentare il prezzo. È intenzionato a sostenere l’industria nella direzione opposta, rendendo la crio-EM più accessibile, rendendola più piccola e semplice. “Siamo tornati al punto di partenza e ci siamo chiesti: ‘Quali di tutte queste funzionalità introdotte possono essere ridotte?'”
“Vogliamo rendere la crio-EM più accessibile e conveniente“, afferma Henderson. “In breve, speriamo di democratizzare la tecnica“. Il suo team si sta consultando con gli ingegneri di JEOL per contribuire a rendere questo obiettivo realtà.
Danev sta anche collaborando con JEOL per contribuire a rendere i microscopi più economici. “Stiamo cercando di rendere la crio-EM più accessibile ottenendo prestazioni simili a quelle di strumenti di fascia alta molto costosi, ma a solo un terzo del costo”, afferma Danev. “E finora abbiamo avuto un discreto successo”.
Un modo per rendere i microscopi più economici è utilizzare elettroni a bassa energia. “Si pensava che usare tensioni elevate come 300 o 400 keV fosse importante, perché si pensava che l’ottica fosse migliore quando si passava ad alte tensioni”, afferma Henderson. “Ma si tratta di un microscopio di grandi dimensioni, e richiede molta tecnologia. Ci siamo chiesti: perché non usare semplicemente 100 keV, che è la tensione usata negli anni ’80?”.
Si è scoperto che utilizzare un microscopio elettronico da 100 keV non solo è più economico, ma può anche accelerare la determinazione della struttura molecolare senza perdere la qualità dell’immagine.
Convinto che questa sia la strada da seguire per il settore, Henderson invita altri ad unirsi a lui nella sua ricerca per rendere la crio-EM più accessibile. “Vorremmo incoraggiare la comunità – ricercatori accademici, ricercatori aziendali, aziende farmaceutiche e produttori di apparecchiature – a collaborare per rendere la crio-EM più facile, veloce e meno costosa, in modo che il settore si espanda“.
GPCR per immagini
Oltre a collaborare con JEOL per sviluppare sistemi crio-EM più economici e compatti, Danev utilizza la crio-EM ad alta risoluzione anche per creare immagini di recettori chiave della membrana cellulare, come i recettori accoppiati alle proteine G (GPCR).
“I GPCR sono probabilmente la famiglia di proteine più importante in termini di farmaci, essendo bersaglio di circa il 35% dei farmaci approvati. E sono molto difficili da studiare strutturalmente”, afferma.
Spingendo al massimo le prestazioni del microscopio e ottimizzando i campioni e le condizioni sperimentali, i ricercatori hanno gradualmente migliorato la risoluzione. “Otteniamo regolarmente strutture con una risoluzione inferiore a 2,5 Å”, afferma Danev.
Il duro lavoro ha dato i suoi frutti. “In collaborazione con un team della Monash University in Australia, abbiamo determinato le strutture di molti complessi GPCR-ligando e abbiamo contribuito ad ampliare la conoscenza delle loro interazioni e dei loro meccanismi funzionali”, aggiunge. Ad esempio, nel 2021 hanno determinato la struttura del semaglutide – ora comunemente noto con il nome commerciale Ozempic – nel suo complesso con il recettore GLP-1R. Da allora è diventato un farmaco di successo a livello globale.
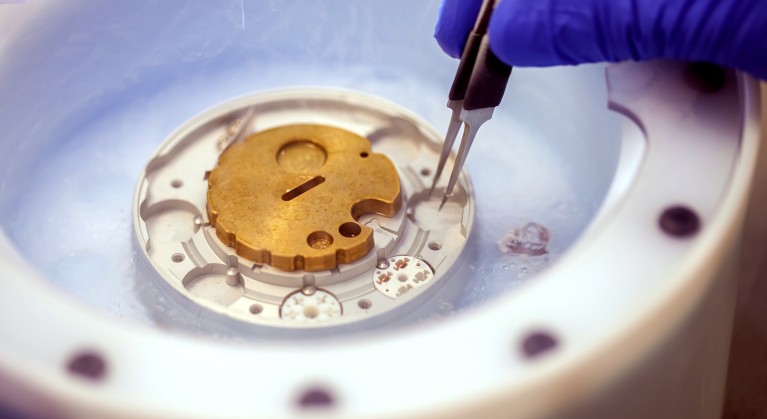
Preparazione di un campione per la microscopia crioelettronica in un bagno di azoto liquido. Crediti: PolakPhoto/Shutterstock
Non solo singole particelle
Gran parte dell’attenzione della comunità crio-EM si è concentrata sulla determinazione delle strutture di singole molecole. Ma la crio-EM può essere utilizzata anche per osservare strutture più grandi nel loro ambiente naturale.
“La crio-EM non riguarda solo singole particelle”, commenta Fleck. “È molto più ampia“.
Ad esempio, la criotomografia elettronica (cryo-ET) è una tecnica leggermente più avanzata che consente lo studio della biologia strutturale in sit. Consiste nella creazione di un’immagine 3D di una sottile fetta di una cellula ruotando il campione e al contempo effettuando misurazioni crio-EM. Questa tecnica, eseguibile su sezioni lamellari utilizzando il sistema di microscopio elettronico a fascio ionico criofocalizzato (cryo-FIB) di JEOL, consente di visualizzare sezioni di cellule e di osservare le biomolecole nel loro ambiente naturale.
Fleck è particolarmente interessato all’imaging volumetrico criogenico di cellule intere. Questo metodo prevede l’acquisizione di un’immagine della superficie di un campione e il successivo utilizzo di una crio-FIB per rimuovere una sottile striscia dal campione e raggiungere lo strato sottostante, ripetendo poi l’intero processo. “Consentendo di sezionare e acquisire immagini ripetutamente in un ambiente criogenico, è possibile costruire un’immagine di un volume 3D”, afferma Fleck.
Fleck sta collaborando con JEOL per migliorare i loro sistemi crio-FIB, che ora consentono agli utenti di trasferire i campioni tra un microscopio ottico e un microscopio crio-EM o di integrare il microscopio ottico nel crio-EM. Questo permette agli utenti di individuare le strutture specifiche che desiderano visualizzare. Sta inoltre integrando il campionamento sparso con l’apprendimento automatico per migliorare la risoluzione delle immagini, il rapporto segnale/rumore e la produttività.
Leggi anche:I raggi X ad alta energia inducono la distruzione di collagene osseo
Guardando al futuro
Fleck ritiene che gran parte del futuro della crio-EM risieda nelle tecniche di imaging di grandi volumi di campioni, anziché delle singole molecole in essi contenute.
“Penso che la crio-ET sarà la prossima grande innovazione”, prevede Fleck. A differenza della crio-EM convenzionale, in cui le molecole di interesse vengono estratte dal loro ambiente, la crio-ET consente di visualizzare le molecole all’interno di una cellula o di una membrana. “È un passo avanti verso il loro stato nativo”, afferma Fleck.
Danev prevede che la crio-EM stessa diventerà molto più facile da usare e più accessibile nei prossimi anni, come altre tecnologie in passato. “Un buon esempio è il sequenziamento genetico. Circa 20 anni fa, era un’impresa epocale”, afferma. “Ma i sequenziatori sono diventati sempre più piccoli e veloci. Credo che qualcosa di simile accadrà nella crio-EM“.
Qualunque sia il futuro della crio-EM, si tratta di una tecnica potente arrivata proprio al momento giusto. “La crio-EM è una tecnica incredibilmente gratificante e praticabile per la ricerca scientifica, in particolare nelle scienze della vita“, afferma Fleck.
Fonntteee: Nature